Tratamiento Hormonal Cruzado de Personas Trans y sus complicaciones
Cross Hormone Treatment of Trans people and its complications
Dra Cecilia Calvar; Dra Noelia Cabrera; Dra Yanina Duran
INTRODUCCIÓN
El término Trans abarca a las personas travestis, transexuales y transgénero, y se define como una incongruencia entre el género biológico y el autopercibido.
En todo el mundo las personas transexuales han sido víctimas de discriminación y marginación, por lo que durante años presentaron condiciones de vida más adversas que la población general (1). Uno de los factores bien establecidos para mejorar la calidad de vida y el funcionamiento psicosocial de las personas trans es el tratamiento hormonal cruzado (THC) (2-4).
Con el fin de facilitar el acceso a la hormonización, varios países sancionaron leyes de identidad de género. En Argentina, es la Ley 26743 la que garantiza la inclusión del THC en el plan médico obligatorio, y el derecho a recibirlo con la sola firma del consentimiento informado (5).
En general la incongruencia de género se expresa desde la infancia y los pacientes inician el tratamiento en su juventud, por lo que pasan la mayor parte de su vida recibiendolo. Sin embargo, aún no es fácil establecer cuál es su seguridad a largo plazo.
En las cohortes de mayor tiempo de seguimiento, los pacientes de más de 20 años de tratamiento no superaban el 10% (6, 7). Además, no existen estudios randomizados por ser éticamente incorrectos. A esto se suma que a lo largo del tiempo cambiaron las medicaciones utilizadas, especialmente en mujeres trans. Por último, si bien en nuestro país no es obligatoria la cirugía de reasignación genital, en otros sí lo es por lo que la evidencia sobre efectos en los órganos genitales es aún menor.
TRATAMIENTO HORMONAL
El tratamiento hormonal cruzado (THC) tiene como objetivos disminuir los caracteres sexuales secundarios del género biológico e inducir los del género autopercibido (8), y es una parte esencial del tratamiento de la incongruencia de género.
Hombres trans
Testosterona
En nuestro país se encuentran 3 formulaciones disponibles de esta medicación, dos intramusculares (Enantato y Undecanoato de Testosterona) y una tópica (Testosterona Gel 1%) (tabla 1).
La presentación a utilizar dependerá de la disponibilidad en el medio y/o de las preferencias del paciente, ya que ninguna de las formas farmacéuticas demostró mayor efectividad que las otras (9).
Un estudio que incluyó 45 varones trans sanos mostró que cualquiera de las 3 formulaciones de testosterona aumentaban de la misma manera los niveles de hormona sérica al rango normal masculino. Además, todos los sujetos presentaron amenorrea al año de tratamiento sin diferencias entre grupos. Tampoco hubo diferencias significativas respecto a los parámetros metabólicos. Luego de 54 semanas, la satisfacción general con la vida fue mayor en los tres grupos por igual (9).
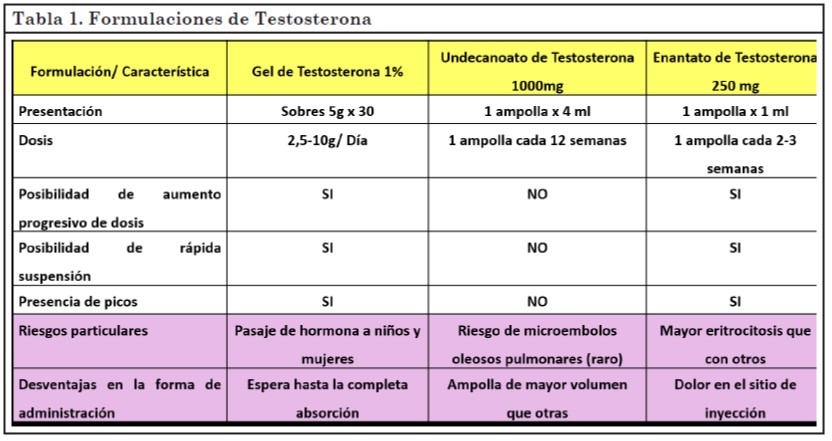
Es conveniente iniciar con dosis bajas y formulaciones de corta vida media para poder suspender rápidamente en caso de efectos adversos. Una vez confirmada la tolerancia del paciente a la medicación se puede continuar con las dosis e intervalos usuales (10).
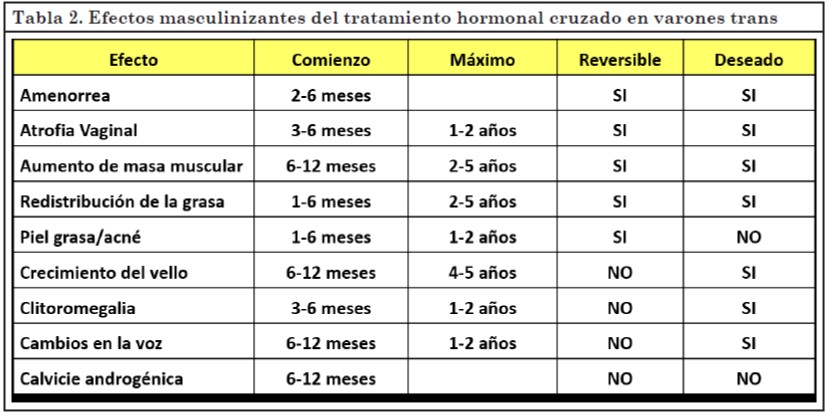
Efectos virilizantes de la Testosterona
Algunos son efectos buscados por el tratamiento y otros se presentan como adversos. En la Tabla 2 se detalla el tiempo de inicio y máxima expresión de cada uno, si son reversibles o no en caso de suspender el THC y si son deseados o no.
Mujeres trans
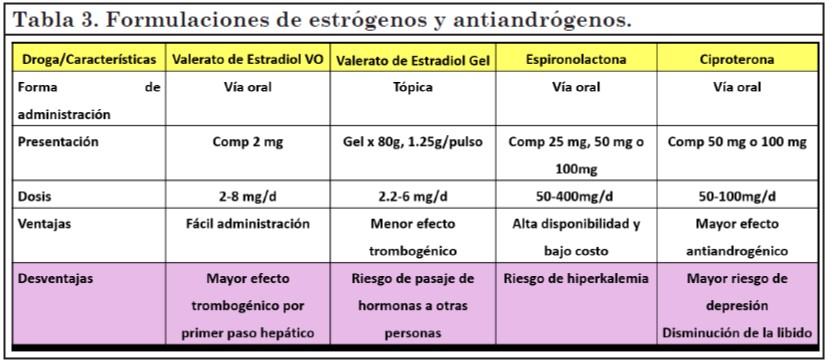
Estrógenos y antiandrógenos
En mujeres trans se utiliza el tratamiento combinado de estrógenos y antiandrógenos, El estrógeno indicado es el 17 beta estradiol o valerato de estradiol, por tener menos riesgos de trombosis venosa y menores efectos adversos sobre lípidos y marcadores de inflamación(11). De los antiandrógenos, en nuestro país se encuentran disponibles la espironolactona y la ciproterona. (tabla 3).
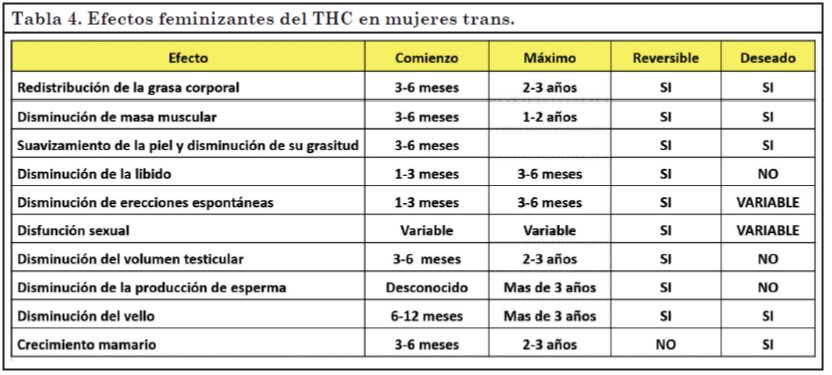
Efectos feminizantes del tratamiento con estrógenos y antiandrógenos
Algunos son efectos deseados y otros se presentan como adversos. En la Tabla 4 se detalla el tiempo de inicio y máximo efecto, si son reversibles y si son deseados.
COMPLICACIONES DEL THC
Para lograr los cambios deseados, las personas trans deben recibir el tratamiento hormonal desde edades muy tempranas y en forma crónica, lo que genera inquietudes sobre la morbi-mortalidad agregada por la hormonización.
Son varias las dificultades que se presentan cuando se estudian posibles complicaciones a largo plazo. En primer lugar, son pocos los centros que tienen registros completos de personas transexuales. Entre el 30 y 40% de los pacientes se pierden en el seguimiento, y el 20% consultan solo cuando presentan complicaciones. También existen diferentes esquemas de tratamiento y no todos los pacientes realizan cirugías, lo que podría inducir mayor riesgo en órganos hormono-sensibles. A esto se suma la imposibilidad de realizar estudios randomizados por ser éticamente incorrectos. Sin embargo, a través de los años se suman conclusiones cada vez más sólidas respecto a este tema. Durante esta sección se analizarán las posibles complicaciones del THC a nivel cardiovascular, sobre la salud ósea y riesgo de tumores hormono-sensibles.
COMPLICACIONES CARDIOVASCULARES
Las muertes por causa cardiovascular ocupan los primeros lugares en la población general. El THC podría potencialmente aumentar el riesgo cardiovascular (RCV) tanto en hombres como mujeres trans. Sin embargo, en estudios de seguimiento a largo plazo no existen evidencias de mayor prevalencia de muerte por estas causas en la población trans respecto de la general (6, 7, 12-14).
EFECTOS SOBRE LOS FACTORES DE RIESGO CARDIOVASCULAR
Mujeres trans
Existe evidencia en la literatura de aumento del RCV en mujeres trans bajo tratamiento hormonal. Sin embargo, muchas de las conclusiones se basaron en esquemas con etinilestradiol (EE), el cual ya no se utiliza por sus múltiples efectos adversos. Resulta imprescindible realizar nuevos estudios prospectivos con 17 beta estradiol para obtener conclusiones más certeras. En adelante se detalla la influencia del THC sobre distintos factores de riesgo cardiovascular en mujeres trans.
Composición corporal
En un estudio sobre la cohorte de Bélgica, la prevalencia de obesidad en mujeres trans previo al inicio tratamiento, fue similar a la de la población general (13). A pesar de que se observó un aumento en el peso (15-18), grasa visceral (17) y grasa corporal total (15, 18) con el THC, un estudio evidenció que luego de 24 meses de seguimiento, el aumento del IMC no se trasladaba a una proporción más alta de pacientes obesas. Al comparar las que habían recibido tratamiento con las que no, las primeras tenían IMC significativamente mayor (19).
Metabolismo de hidratos de carbono
La prevalencia de DBT 2 en la cohorte belga previo al inicio de tratamiento fue mayor que en la población general (13). Con el THC si bien no se observaron cambios en la glucemia, se constató aumento de la insulinemia con disminución de la insulino-sensibilidad (15, 16, 18).
Perfil lipídico
No se ha documentado evidencia de cambios significativos sobre el colesterol total (CT) ni el LDL (20, 21). Respecto al HDL, mientras algunos autores no reportaron cambios significativos (20, 21) otros observaron aumento del mismo luego del THC (15, 18). Un estudio que comparó el tratamiento con acetato de ciproterona respecto de leuprolide (análogo GnRH) evidenció como única diferencia entre ambos, valores significativamente mayores de HDL en el grupo con leuprolide (22).
Respecto de los triglicéridos, los hallazgos son variables. Mientras un metanálisis reporta aumento en las concentraciones séricas de los mismos (20), estudios posteriores reportaron disminución (7) o ausencia de cambios (19). Un metanálisis más reciente (presentado en el congreso ENDO 2017) sobre 3238 mujeres trans, reportó que las mismas presentaban valores de triglicéridos significativamente mayores sobre todo a los 24 meses del tratamiento hormonal (21).
Tensión arterial (TA)
Sobre la TA, algunos investigadores no observaron diferencias (20), otros reportan una disminución de los valores luego del THC (7) o incluso aumento pero dentro del rango normal(19). Si bien los resultados no son coincidentes, al parecer no habría mayor riesgo de hipertensión arterial (HTA) con la hormonización.
Diferencias entre la vía de administración del valerato de estradiol
Los estrógenos transdérmicos podrían presentar un menor impacto sobre factores de riesgo cardiovascular que los orales por ser menos pro-aterogénicos.
Un estudio que analizó las diferencias entre ambas vías de administración, reportó aumento de marcadores inflamatorios en mujeres trans que recibían estrógenos orales, pero no en las que los recibían por vía transdérmica (23).
Además, en el metanálisis más reciente sobre mujeres trans, se observó que en aquellas tratadas con estrógenos transdérmicos, los valores séricos de triglicéridos y HDL eran significativamente menores que en el grupo de estrógenos orales (21).
Hombres Trans
A pesar de la evidencia de la inducción de cambios pro-aterogénicos sobre el perfil lipídico y redistribución de la grasa, el THC en varones trans parecería ser seguro a largo plazo (6, 7, 12, 13). En adelante, reportamos la influencia del THC sobre factores de RCV en varones trans.
Composición corporal
En la cohorte de Bélgica, la prevalencia de obesidad en varones trans resultó similar a la de población general (13). Al evaluar los cambios en la composición corporal luego del tratamiento, se observó disminución de la grasa subcutánea, aumento de la grasa visceral (15, 17), disminución de la masa grasa total y aumento de la masa muscular (9, 17, 24-28).
Respecto del IMC, si bien un estudio no reportó cambios (29), otros hallaron un aumento significativo del mismo (16-18).
Metabolismo de hidratos de carbono
La tasa de prevalencia de diabetes tipo 2 (DBT 2) en la cohorte belga fue significativamente mayor que en el grupo control de mujeres cis (no trans) (13).
Estudios que evaluaron el impacto del THC sobre la glucemia no observaron cambios significativos (29, 30), e incluso uno de ellos reportó disminución (16). Respecto de la insulinemia los valores fueron similares a los previos al inicio del tratamiento (15, 16, 18), y al analizar el impacto sobre la insulino-sensibilidad se reportó ausencia de cambios (15, 31) o una leve disminución (18).
Perfil lipídico
En cuanto a la influencia del THC sobre el perfil lipídico, se reportó aumento significativo en los niveles séricos de triglicéridos y disminución en el HDL (15, 20, 21, 29, 30). Los resultados sobre el LDL son contradictorios, ya que mientras algunos estudios no reportan cambios (15, 20, 30), un reciente metanálisis observó un aumento significativo (21). Sobre el CT, investigaciones previas no observaron cambios significativos (20, 30), otras reportaron niveles significativamente mayores en el grupo de tratamiento (29), mientras que en el metanálisis de 2016 solo se observó aumento en el grupo que recibía testosterona intramuscular (21).
Tensión arterial
Dos estudios reportaron aumento en las concentraciones séricas de endotelina, la cual está asociada con vasoconstricción e HTA (32, 33).
Sin embargo, los hallazgos sobre los cambios en la TA son contradictorios, mientras algunos investigadores reportan aumentos significativos en los valores de TA (29, 34), otros observaron que esta disminuía luego del tratamiento (20) o se mantenía sin cambios (15, 30). Resulta necesario realizar un mayor número de estudios prospectivos para obtener conclusiones más certeras respecto a este punto.
EVENTOS CARDIOVASCULARES
TROMBOEMBOLISMO
En varones trans no existe mayor riesgo de tromboembolismo que en la población general (7, 21). En mujeres trans, si bien los eventos trombóticos se han reducido considerablemente en los últimos 40 años, parecerían ser más frecuentes que en la población general y que en las mujeres cis que usan anovulatorios y terapia de reemplazo hormonal (35, 36).
En un estudio realizado en Amsterdam en el año 1989, el riesgo de tromboembolismo en mujeres trans bajo tratamiento con EE y ciproterona era 45 veces superior al de la población general. Esto se asoció claramente con la edad (2.1% en las menores de 40 años y 12% en las mayores de 40 años) y con el uso de EE (37).
Fue esta evidencia la que derivó en que se estandarizara el tratamiento con estradiol en todas las pacientes y se recomendara la vía transdérmica para las mayores de 40 años.
En la cohorte de 1997 con mayor cantidad de pacientes (n=816) y más años de seguimiento (media 9,5 años) la incidencia de eventos tromboembólicos había disminuido (n=45), aunque el riesgo era 20 veces mayor que en la población general. Sin embargo, en el grupo que recibía estradiol transdérmico (n=138), sólo hubo un evento (36).
En la cohorte de Viena del año 2010 (n=162), el tratamiento recibido fue 17 beta estradiol combinado con ciproterona o finasteride previo a la cirugía de reasignación genital, y posterior a ésta solo con 17 beta estradiol. No se observó ningún evento tromboembólico durante el seguimiento, sin embargo 5 pacientes habían presentado eventos previos y todas ellas habían estado automedicadas con EE y ciproterona (35).
En 2012 el grupo de Wierckx observó en su muestra de 50 mujeres trans, 3 eventos tromboembólicos (dos cerebrales y uno venoso) durante el tratamiento. Una participante presentó trombosis venosa profunda (TVP) y tromboembolismo pulmonar antes de iniciar la THC, y en ese caso el tratamiento con estrógenos se combinó con anticoagulantes. Además, una paciente presentó un accidente isquémico transitorio (AIT).
Solo una de las participantes que sufrió tromboembolismo o un evento cardiovascular no era fumadora. La incidencia estimada de trombosis en este estudio fue del 2%, sustancialmente menor que en estudios anteriores. Los autores llegan a la conclusión de que es probable que esto suceda porque se mantuvieron los niveles séricos de estradiol normales y se utilizó 17 beta estradiol para el tratamiento (7).
En un estudio retrospectivo aún no publicado, realizado en 6 centros de Estados Unidos y 9 centros europeos, se estudió a 1076 mujeres trans, de las cuales ninguna había sido tratada con etinilestradiol. Los investigadores reportaron solo 1% de TVP (38).
Por otra parte, en un metanálisis no publicado, se reportó un total de 75 eventos de TVP sobre 2077 mujeres tans. La incidencia en los estudios incluidos osciló entre 0 y 6% (21).
Los datos de la literatura llevan a concluir que si bien existe riesgo mayor de trombosis con la terapia estrogénica, este se puede reducir significativamente al evitar el uso de EE. De todas formas, es muy importante trabajar para disminuir los factores de riesgo y suspender el tratamiento previo a las cirugías.
Estradiol vía oral vs transdérmico
Al evitar el primer paso hepático de los estrógenos se podría disminuir el riesgo de tromboembolismo (39, 40). En la cohorte de Viena, no se reportó ningún evento utilizando la vía transdérmica(35).
EVENTOS CORONARIOS Y CEREBRALES
Mujeres trans
Existe evidencia bibliográfica contundente de un aumento del riesgo cardiovascular en mujeres trans, especialmente debido al mayor riesgo de tromboembolismo (6, 7, 13, 14, 20, 21, 36). Sin embargo, al analizar eventos isquémicos los resultados de las diversas investigaciones son dispares.
En el año 1997 el grupo de Van Kesteren concluyó que excluyendo los eventos trombóticos, no existía aumento de riesgo cardiovascular respecto de la población general. Se reportaron 10 casos de infarto agudo de miocardio (IAM), 6 de ellos fatales (SIR: IC 95% 0.5 (0.24-0.91)) (36). En línea con esto, un meta-análisis reciente concluyó que no existía mayor riesgo de mortalidad cardiovascular en mujeres trans. Se reportaron 8 accidentes cerebrovasculares (ACV) y 16 IAM (23 de ellos fatales) en pacientes mayores de 50 años y con corto tiempo de tratamiento (21).
En otro metanálisis del año 2010, si bien los autores aclararon que no podían extraer conclusiones sólidas respecto a mortalidad cardiovascular, parecería haber un aumento de riesgo en la población de mujeres trans respecto de los varones trans (20). En 2011, Asscheman y col reportaron aumento en el riesgo cardiovascular que atribuían en forma probable a la presencia de factores de riesgos y la utilización de EE. Reportaron 18 IAM fatales y 5 ACV (6). En línea con estos hallazgos, en el 2012 Wierck y colaboradores observaron un aumento en la incidencia de ACV respecto de la población general, que también se podían relacionar parcialmente con la presencia de otros factores de riesgos (7). En el 2013, este mismo grupo confirma sus conclusiones acerca de una mayor prevalencia de IAM en mujeres trans (13).
Varones Trans
Diversos estudios de seguimiento a largo plazo no observaron un aumento de morbi-mortalidad por causa cardiovascular en varones trans hormonizados respecto de la población general y las mujeres trans (6, 7, 13, 20, 21, 36). En un metnálisis de 2010 los autores aclaran que a pesar de no observar un aumento del riesgo, los datos resultan insuficientes para establecer conclusiones sólidas respecto de mortalidad cardiovascular debido al poco tiempo de seguimiento (20).
CAMBIOS SOBRE EL HUESO Y RIESGO DE OSTEOPOROSIS
In vitro, tanto la exposición a estrógenos como a andrógenos estimula la función osteoblástica y suprime la osteoclástica. Esto se confirma en humanos al observar la asociación entre hipogonadismo y aumento en el riesgo de fracturas en ambos sexos, que se revierte en forma parcial con la terapia de reemplazo hormonal (41). También se demostró que existe un dimorfismo sexual en la geometría ósea con huesos más fuertes en los hombres (42).
Mujeres Trans
Las investigaciones que evaluaron las diferencias en el metabolismo óseo entre mujeres trans y varones cis previo al inicio del THC, encontraron que las mujeres trans presentaban menor DMO en cadera, cuello femoral y corporal total y mayor prevalencia de osteoporosis (16% vs 2.1%). Por otra parte, la corteza ósea fue más fina en radio y tibia. Además estos trabajos reportaron menor masa y fuerza muscular, mayor masa grasa y menores niveles de vitamina D en las mujeres trans que en los varones cis (43, 44). Estas diferencias previas al inicio del tratamiento podrían deberse al sedentarismo, menor exposición solar por hábitos nocturnos y mayor prevalencia de HIV en la población de mujeres trans.
La mayoría de los trabajos que evaluaron mujeres trans luego de 1 o 2 años de tratamiento, observaron un aumento de la DMO en columna, cadera (26, 45-49), radio y corporal total (46). Uno de éstos reportó también estabilidad en la geometría del hueso cortical y trabecular luego de 2 años de tratamiento (46).
Los marcadores de recambio óseo disminuyeron sin encontrar diferencias entre las que presentaban disminución de la masa ósea y las que no la presentaban (46, 48). Hubo un subgrupo de pacientes que recibió antiandrógenos solos previo a la combinación con estrógenos. En ellas se observó que los marcadores óseos aumentaban al inicio pero disminuían en el segundo año de tratamiento, cuando ya se encontraban con estrógenos y antiandrógenos. No hubo diferencias significativas en parámetros volumétricos o sobre área ósea, lo que podría indicar que el uso de antiandrógenos solos por corto tiempo podría ser bien tolerado en la salud ósea de las mujeres trans (46).
No hubo diferencias en el tamaño o densidad del hueso entre las pacientes que recibían estrógenos transdérmicos u orales (50).
En las mujeres trans que habían estado suplementadas con vitamina D se observó un mayor aumento de la DMO en columna y cuello femoral respecto de las que no la habían recibido (45).
Estudios de corte transversal luego de varios años de THC y orquidectomía observaron que las mujeres trans tenían menor área de densidad mineral ósea (aDMO), volumen de densidad mineral óseo (vDMO) y menor tamaño óseo que los varones cis (43, 50). En otro estudio no se encontró diferencias significativas entre DMO de mujeres trans y hombres cis, pero sí se observó que las mujeres trans tenían mayor DMO que las mujeres cis (51).
Varones Trans
De los estudios que compararon varones trans previo al inicio del tratamiento con mujeres cis, uno de ellos no encontró diferencias significativas en aDMO, vDMO trabecular y cortical ni en la geometría ósea (24), otros hallaron un valor levemente mayor en la aDMO en cuello femoral (25, 52). Tampoco observaron diferencias significativas entre masa grasa y masa magra ni en los niveles de actividad física (24). A diferencia de las mujeres trans, no existe mayor prevalencia de osteoporosis previo al inicio del tratamiento, en esta población (7).
Cuando se analizaron los cambios en la DMO al año de tratamiento, hubo una modesta ganancia de DMO en cadera total (24, 28, 45) y vDMO del hueso trabecular del radio distal (24, 28). Sobre la DMO en columna lumbar, se evidenció un aumento significativo especialmente en varones trans mayores a 50 años (45). Por otra parte, los marcadores de formación ósea aumentaron al año de tratamiento (24, 28).
La única situación donde hubo una disminución significativa de la DMO respecto de la línea de base, fue en un estudio donde se combinó testosterona con letrozole (inhibidor de la aromatasa). Al analizar los marcadores de recambio óseo, se constató disminución de los niveles de osteocalcina sin cambios en la PTH (27).
Rol de las gonadotrofinas luego de la cirugía de reasignación genital
Se postula que el nivel de gonadotrofinas podría ser un marcador para el monitoreo del THC a partir de un trabajo que observó que la disminución de la DMO se relaciona inversamente con los niveles de LH y FSH (48) y el Z-score de columna lumbar de las mujeres trans. Esto no pudo ser reproducido en un estudio del año 2009 (50).
RIESGO DE TUMORES HORMONO-SENSIBLES
Con el THC podrían generarse cambios sobre órganos hormono-sensibles como la mama en ambos géneros, útero y ovarios en varones trans y testículos, hipófisis y próstata en mujeres trans. Establecer el riesgo de desarrollo de tumores hormono-sensibles en esta población no es sencillo debido a que la incongruencia de género es poco prevalente y los pacientes con seguimiento a largo plazo son menos aún. Por lo tanto, sobre el desarrollo de algunos de estos tumores sólo existen reportes aislados de casos que no permiten sacar conclusiones sobre el aumento o no de riesgo respecto de la población general.
CÁNCER DE MAMA
Hombres Trans
Aún no está claro cuáles serían los efectos de los andrógenos en la patogenia del cáncer de mama. Algunos estudios no han podido confirmar una correlación positiva entre la testosterona y dicha patología (53, 54). Otros, basados en la observación de cáncer de mama en pacientes con niveles supra fisiológicos de testosterona sérica (55), sugieren un potencial riesgo aumentado secundario a un up y down regulation de genes relacionados con estos tumores (56). Sin embargo, en esta situación también podrían influir los estrógenos surgidos de la aromatización de la testosterona en la mama.
Es debido a este riesgo teórico aumentado que varios investigadores se dedicaron a evaluar la incidencia de cáncer de mama en la población de varones trans (57, 58).
En el estudio sobre veteranos trans del año 2015 se reportaron 7 casos de cáncer de mama en varones trans. Solo uno de ellos se encontraba bajo tratamiento con testosterona al momento del diagnóstico. De los 6 casos restantes, 3 comenzaron con el THC varios años después del diagnóstico, 2 habían recibido tratamiento con estrógenos 12 años previo y 1 nunca recibió ningún tipo de tratamiento hormonal. La incidencia estimada para varones trans bajo testosterona fue de 105,2/100.000 personas-año (IC 95% 3,16-585,8), similar a la de la población norteamericana de mujeres cis (58).
La incidencia estimada en el estudio de Gooren del año 2013 fue de 5,9/100.000 personas-año (IC 95% 0,5-27,4/100.000 personas/año), lo que resulta en una incidencia menor que la esperada para mujeres cis (154,7/100.000 personas-año) y varones cis (1,1/100.000 personas-año) (59). Esto podría deberse a la alta prevalencia de mastectomías en esta población.
En la Tabla 5 se describen los 10 casos de cáncer de mama en varones trans bajo THC reportados en la literatura (55, 57, 60-63).
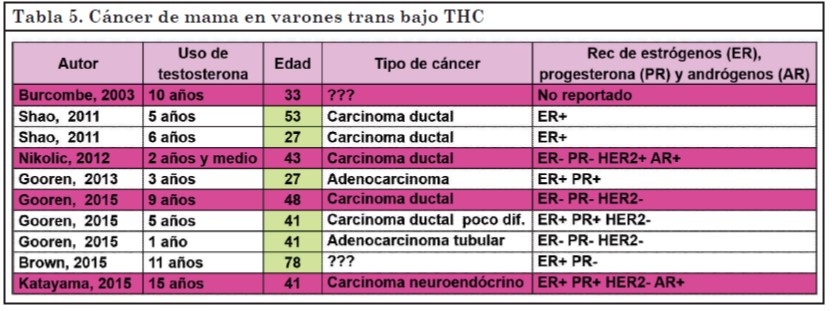
Los cuatro pacientes que se resaltan habían sido mastectomizados, lo que evidencia una susceptibilidad que persiste aún luego de la cirugía. Por este motivo se debe continuar con los controles habituales sobre todo en la región axilar y aún más si existen antecedentes familiares o factores de riesgo para el desarrollo de cáncer de mama (59, 61).
Mujeres Trans
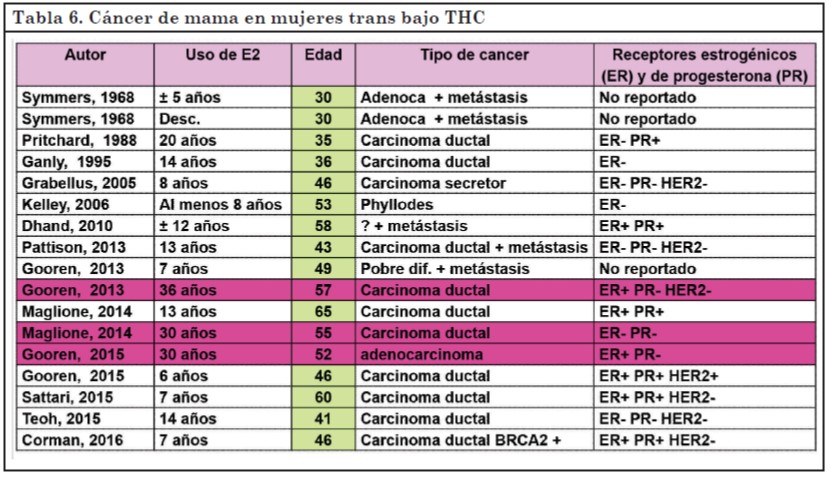
En mujeres trans bajo THC, se han reportado 17 casos de cáncer de mama.
El cáncer de mama se suele observar en pacientes más jóvenes y con mayor frecuencia de receptores estrogénicos negativos que en los hombres cis (61, 64).
En el estudio con la mayor cohorte de mujeres trans, se reportaron 3 casos de cáncer de mama, sin embargo ninguno fue bajo terapia estrogénica. El radio estandarizado de incidencia esperada en pacientes bajo THC fue 0,03 (IC 95% 0-3,69)(58).
Otro grupo de investigadores, en el año 2013 reportaron una incidencia de cáncer de mama en su cohorte de 4,1/100.000 personas-año (IC 95% 0,8-13,0 por 100.000 pacientes-año). Esto resulta en una incidencia esperada menor a la de las mujeres cis (170/100.00 personas-año), pero mayor a la de los varones cis (1,2 por 100.000 pacientes-año).
Estos hallazgos sugieren, que sería razonable realizar screening para cáncer de mama con mamografías, sobre todo si hay antecedentes familiares de ésta patología (64). Esto es apoyado por el reciente reporte de una paciente que desarrolló cáncer de mama 7 años después de iniciar la THC y es el primer caso con BRCA 2 positivo (65).
En la Tabla 6 se detallan los casos reportados. Solo en 3 de ellos se respetaría el patrón femenino, donde el diagnóstico habitualmente se realiza luego de al menos 30 años de exposición a estrógenos (57, 61, 64-69).
CAMBIOS UTERINOS Y RIESGO DE CÁNCER DE ENDOMETRIO
En el endometrio la testosterona puede convertirse tanto a dihidrotestosterona (DHT) como a estradiol. Mientras la DHT tiene efectos antiproliferativos, los estrógenos estimulan su proliferación (70). Además, los andrógenos podrían aumentar los receptores del factor de crecimiento epidérmico (71). Esta información concuerda con observaciones de mayor riesgo de cáncer de endometrio en mujeres postmenopáusicas con altos niveles de testosterona (72, 73) y con SOP (71, 74, 75).
Dos estudios examinaron los efectos de la testosterona en el endometrio de varones trans con resultados inconsistentes (76, 77). En uno de ellos la mitad de los participantes presentaba endometrio atrófico y otra mitad proliferativo. Uno de los pacientes presentó una hiperplasia endometrial atípica con un pequeño foco de adenocarcinoma luego de 7 años de THC (76). La otra investigación reportó que la totalidad de sus participantes presentaron endometrios atróficos (77).
CAMBIOS OVÁRICOS Y RIESGO DE CÁNCER DE OVARIO
Respecto del ovario, se han realizado estudios anatomopatológicos con resultados inconsistentes. Mientras algunos autores reportaron disminución de la corteza y el estroma sin aumento en el número de folículos antrales (78), otros observaron un mayor número de estos últimos con morfología de ovario poliquístico (76, 79).
Los cambios histológicos que produce la testosterona en el ovario con aumento de la expresión de factores de crecimiento y receptores androgénicos, están asociados a mayor riesgo de cáncer epitelial de ovario (80, 81).
Se reportaron 3 casos de cáncer de ovario en varones trans (82, 83). Ambos autores concluyen que la prevalencia de esta patología podría estar aumentada en este grupo respecto de la población general, por lo que sugieren considerar la salpingooforectomía bilateral, especialmente en pacientes pobremente estudiados para riesgos de cáncer de ovario.
En los 3 casos de cáncer de ovario reportados, la edad de presentación fue menor que la habitual en mujeres (60 años), y dos de ellos fueron positivos para receptores androgénicos, lo que sugiere que podrían tener un rol en el desarrollo del tumor.
CÁNCER DE PRÓSTATA
En las mujeres trans, cuando se realizan la cirugía de reasignación genital no se extirpa la próstata por el riesgo de posibles complicaciones, como la incontinencia urinaria. Aún cuando estas pacientes estén en tratamiento con estrógenos luego de la orquidectomía, habría evidencia de que el tejido prostático persiste activo, por lo que esta actividad no estaría relacionada únicamente a los andrógenos (84).
Solo hay un estudio sobre cáncer de próstata en mujeres trans, que analizó 7 casos reportados en la literatura y calculó una incidencia de cáncer de próstata en esta población de 0,04% y una incidencia en mayores de 40 años de 0.13%. Aunque esta tasa es mucho menor que la que se observa en hombres cis de 40 a 60 años (3.18%) no debería menospreciarse la pesquisa anual con PSA, ya que de los pocos casos publicados, 5 fueron en pacientes luego de varios años de tratamiento, fueron más frecuentemente metastásicos y tenían mayor aumento de PSA a pesar de los bajos niveles de testosterona. Esta situación habla de un fenotipo de cáncer de próstata independiente de andrógenos, lo que se asocia a mayor agresividad (85, 86).
ESTRADIOL Y PROLACTINOMA
Los prolactinomas son el tumor de hipófisis más frecuente. Se presentan mayormente en mujeres entre 20 y 50 años. Los estrógenos son potentes estimuladores de la síntesis y secreción de prolactina (87, 88).
Aún en pacientes transexuales bajo terapia estrogénica crónica, esta es una patología infrecuente. En la literatura hay un total de 6 casos descriptos, y todas las pacientes menos una reportaban automedicación con dosis de estrógenos mucho mayores a las recomendadas.
MORTALIDAD POR TODAS LAS CAUSAS
Mientras algunos investigadores no encontraron una mayor tasa de mortalidad global en la población trans respecto de la población general (36, 37), otros concluyen lo contrario reportando un riesgo de mortalidad hasta 3 veces superior (6, 14).
Un reciente metanálisis arrojó una mortalidad de 0 a 3% en su muestra de varones trans y de 0 a 12% en mujeres trans (21). Cuando se analizó la edad de muerte de 592 personas trans en nuestro país, el 9% había fallecido antes de los 21 años, el 43% entre los 22 y 31 años y el 33% entre los 32 y 41 años (89). La expectativa de vida en la población de veteranos trans fue de 64,2 años (12).
Al analizar las causas específicas de muerte, todos coinciden en que la de mortalidad debido a suicidios, abuso de sustancias y HIV es altamente superior a la de la población general, siendo los grupos más vulnerables el de menores de 40 años y mujeres trans (6, 12, 14, 36, 37). Igualmente, entre los 40 y los 60 años continúa observándose mayor mortalidad a causa de suicidios y se agrega la causa cardiovascular. En las personas trans mayores de 65 años no se constató un aumento de mortalidad respecto a la población general (6, 36).
La cohorte Suiza fue la única en la que se observó un moderado aumento de mortalidad cardiovascular respecto de la población general, aunque los autores aclaran que este dato debería tomarse con cautela por el bajo número de eventos registrados (14).
Respecto al riesgo de cáncer, si bien en el estudio suizo se evidencia un leve aumento de riesgo de mortalidad por neoplasias respecto de la población general (14), esto no pudo ser reproducido en otras investigaciones (6, 12, 13, 36). Igualmente hay coincidencia respecto a que las neoplasias desarrolladas durante el seguimiento no se encontraban relacionadas al THC (6, 12-14, 36).
Si bien resulta poca la evidencia, todos los estudios coinciden en el aumento de mortalidad provocado principalmente por suicidios sin aumento de mortalidad cardiovascular o por neoplasias respecto de la población general, a pesar de haber recibido THC por tiempos prolongados.
CONCLUSIONES
La población trans se presenta como un grupo sumamente vulnerable tanto social como psicológicamente. En los últimos años, se trabajó especialmente para brindar condiciones que faciliten el mejor funcionamiento psicosocial de estos pacientes. La Ley 26.743 demostró haber sido efectiva no solo para lograr un mejor funcionamiento social de esta población, sino también para facilitar el acceso al THC.
Este último es imprescindible para que sea efectiva la adecuación de género. No solo induce cambios fenotípicos hacia el género autopercibido, sino que también evita el desarrollo de osteoporosis luego de la cirugía de reasignación genital.
Al iniciar el seguimiento de los pacientes se presentan varios problemas a los profesionales de la salud. La poca adherencia al tratamiento, la alta prevalencia de automedicación con efectos deletéreos en la salud sobre todo de mujeres trans y la pobre evidencia sobre complicaciones a largo plazo.
Las mayores dificultades respecto del último punto son debido a la escasa cantidad de pacientes con más de 20 años de tratamientos supervisados que no permite sacar conclusiones sólidas sobre mortalidad cardiovascular, fracturas y desarrollo de cáncer. Sin embargo, si bien aún existen múltiples interrogantes, existen algunas evidencias.
El tratamiento en varones trans parecería ser seguro a corto y mediano plazo. Sin embargo, es imprescindible monitorear posibles efectos adversos a nivel cardiovascular sobre todo por la mayor prevalencia de diabetes, los cambios negativos en el perfil lipídico y los probables aumentos en el hematocrito por la testosterona.
Las mujeres trans son claramente el grupo más vulnerable, aunque los nuevos esquemas de tratamiento lograrían disminuir el riesgo considerablemente.
El etinilestradiol es una medicación claramente deletérea en la salud de las pacientes.
Al momento de decidir la vía de administración del estradiol, parecería ser que la vía transdérmica es más segura sobre todo en relación al riesgo cardiovascular. Es muy importante interrogar en forma exhaustiva a las pacientes acerca de cualquier factor de riesgo para trombosis.
El momento de la consulta médica se presenta también como una oportunidad para fomentar hábitos saludables, los cuales tendrían un impacto sumamente positivo disminuyendo las complicaciones.
Sobre los riesgos de cáncer a largo plazo, si bien no existe mayor riesgo de cáncer de mama es conveniente realizar los controles habituales, sobre todo si existen antecedentes familiares. En varones trans continúa siendo importante el control ginecológico ya que la mastectomía no evita totalmente el desarrollo de cáncer de mama, existe un probable aumento de riesgo de cáncer de ovario y sería conveniente monitorear los efectos de la testosterona en el endometrio. En mujeres trans se debe realizar el control anual con PSA.
Resulta imprescindible realizar nuevos estudios a largo plazo con mayor cantidad de pacientes bajo los esquemas de tratamiento actuales para obtener datos sobre riesgo de fracturas, eventos cardiovasculares e incidencia de cáncer.
Palabras Clave: trans, tratamiento hormonal cruzado,hormonización, niñas/os trans, disforia de genero
Servicio de Endocrinología del Hospital J A Fernández, Buenos Aires, Argentina.
E-mail: Esta dirección de correo electrónico está siendo protegida contra los robots de spam. Necesita tener JavaScript habilitado para poder verlo.
BIBLIOGRAFÍA
- Winter S, Diamond MG, J; Karasic, D; Reed, T; Whittle, S; Wylie K. Transgender people: health at the margins of society. Lancet. 2016;Published online.
- Murad M, Elamin MG, M; Mullan, R; Murad, A.; Erwin, P.; Montori, V. Hormonal therapy and sex reassigment: a sistematic review and meta-analysis of quality of life and psychosocial outcomes. Clin Endocrinol (Oxf). 2010;72(2):214-31.
- Gomez-Gil E Z-EL, Esteva I, Guillamon A, Godas T, Cruz Almaraz M, Halperin I, Salamero M. Hormone-treated transsexuals report less social distress, anxiety and depression. 2012;37(5):662-70.
- Gorin-Lazard A BK, Boyer L, Maquigneau A, Gebleux S, Penochet JC, Pringuey D, Albarel F, Morange I, Bonierbale M, Lançon C, Auquier P. Is hormonal therapy associated with better quality of life in transsexuals? A cross sectional study. The Journal of sexual medicine. 2012;9(2):531-41.
- Ley 26743, (2012).
- Asscheman H GE, Megens JAJ, de Ronde WP, Michael A, Van Trotsenburg MA, Gooren LJG. A long-term follow up study of mortality in transsexuals receiving treatment with cross-sex hormones. European Journal of Endocrinology 2011;164:635-42.
- Wierckx K MS, Weyers S, Van Caenegem E, Roef G, Heylens G, T´Sjoen G. Long-Term evaluation of Cross-sex Hormone treatment in transexual persons. J Sex Med. 2012;9:2641-51.
- Fisher AD CG, Bandini E, Casale H, Fanni E, Benni L, Ferruccio N, Meriggiola MC, Manieri C, Gualerzi A, Jannini E, Oppo A, Ricca V, Maggi M, Rellini AH. Cross-sex hormonal treatment and body uneasiness in individuals with gender dysphoria. J Sex Med. 2014;11(3):709-19.
- Carla Pelusi AC, Martelli Valentina, Lambertini Martina, Bazzocchi Alberto, Ponti Federico, Battista Giuseppe, Venturoli Stefano, Meriggiola Maria. Effects of Three Different Testosterone Formulations in Female-to-Male Transsexual Persons. J Sex Med. 2014;11:3002-11.
- guidelines Tessc. Endocrine treatment of transsexual persons: An endocrine society clinical practice guideline. Journal of Clinical Endocrinology & Metabolism. 2009;94(9):3132-54.
- Asscheman H. TSG, Lemaire A., Mas M, Meriggiola M.C, Mueller A., Kuhn A., Dhejne C., N. Morel-Journel, Gooren L.J. Venous thrombo-embolism as a complication of cross-sex hormone treatment of male-to-female transsexual subjects: a review. Andrologia. 2014;46:791–5.
- Blosnich JR BG, Wojcio S, Jones KT, Bossarte RM. Mortality among veterans with transgender-related diagnoses in the veterans health administration, fy2000–2009. LGBT Health. 2014;1(4):269-76.
- Wierkx K EE, Declercq E, Heylens G, De cuypere G, Taes Y, Kaufman JM, T´Sjoen G. Prevalence of cardiovascular disease and cáncer during cross-se hormone therapy in a large cohort of trans persons: a case-control study. European Journal of Endocrinology. 2013;169:471-8.
- Dhejne C LP, Boman M, Johansson ALV, Långström N, Landén M. Long-Term Follow-Up of Transsexual Persons Undergoing Sex Reassignment Surgery: Cohort Study in Sweden. PLoS ONE [serial on the Internet]. 2011; 6(2).
- Elbers JG, EJ; Teerlink, T; Scheffer, PG; Asscheman, H; Seidell, JC; Gooren, LJ. Effects of sex steroids on components of the insulin resistance syndrome in transsexual subjects. Clin Endocrinol (Oxf). 2003;58(5):562-71.
- Giltay EL, J; Gooren, LJ; Elbers, JMH; Steyn, M; Stehouwer, CDA. Sex steroids, insulin, and arterial stiffness in women and men. Hypertension. 1999;34:590-97.
- Giltay EE, JM; Gooren, LJ; Emeis, JJ; Kooistra, T; Asscheman, H; Stehouwer, CD. Visceral fat accumulation is an important determinant of PAI-1 levels in young, nonobese men and women: modulation by cross-sex hormone administration. Arteriosclerosis, Thrombosis, and Vascular Biology. 1998;18:1716–22.
- Gooren LJ GE. Men and women, so different, so similar: observations from cross-sex hormone treatment of transsexual subjects. Andrologia. 2014;45(5):570-75.
- Quirósa C. PI, Moraa M., Arandaa G.B, Hanzua F.A., Gómez-Gilb E, Godás T, Halperina I. Effect of cross-sex hormone treatment on cardiovascular risk factors in transsexual individuals. Experience in a specialized unit in Catalonia. Endocrinol Nutr. 2015;62(5):210-6.
- Elamin MG, MZ; Murad, MH; Erwin, PJ; Montori, VM. Effect of sex steroid use on cardiovascular risk in transseual individuals: a systematic review and meta-analyses. Clin Endocrinol (Oxf). 2010;72(1):1-10.
- Maraka SSO, NM; Rodriguez-Gutierrez, R; Davidge-Pitts, CJ; Nippoldt, TB; Murad, MH. Effect of sex steroids on lipids, venous thromboembolism, cardiovascular disease and mortality in transgender individuals: a systematic review and meta-analysis. 2016.
- Gava G CS, Martelli V, Battista G, Seracchioli R, Meriggiola MC. Cyproterone acetate vs leuprolide acetate in combination with transdermal oestradiol in transwomen: a comparison of safety and effectiveness. Clinical Endocrinology. 2016;0(1-8).
- Wilson RS, A; Ewan, J; Johnson, P; Jenkins, C; Carr, S. Effects of high dose oestrogen therapy on circulating inflammatory markers. Maturitas. 2009;62(3):281-6.
- Van Caenegem EW, K; Taes, Y; Schreiner, T; Vandewalle, S; Toye, K; Lapauw, B; Kaufman, JM; T´Sjoen, G. Body composition, bone turnover, and bone mass in trans men during testosterone treatment: 1-year follow up data from prospective case-controlled study (ENIGI). European Journal of Endocrinology. 2015;172:163-71.
- Haraldsen IH, E; Falch, J; Egeland, T; Opjordsmoen, S;. Cross-sex pattern of bone mineral density in early onset gender identity disorder. Horm Behav. 2007;52:334-43.
- Mueller A ZH, Kronawitter D, Oppelt PG, Claassen T, Hoffmann I, Beckmann MW, Dittrich R. Body composition and bone mineral density in male-to-female transsexuals during cross-sex hormone therapy using gonadotrophin-releasing hormone agonist. Clin Endocrinol Diabetes. 2011;119:95-100.
- Meriggiola MA, F; Costantino, A; Altieri, P, Saad, F; Kalhorn, T; Perrone, AM; Ghi, T; Pelusi, C; Giuseppe Pelusi, G. Effects of testosterone undecanoate administered alone or in combination with letrozole or dutasteride in female to Male transsexuals. J Sex Med. 2008;5:2442–53.
- Van Caenegem E, Wierckx K, Taes Y, Dedecker D, Van de Peer F, Toye K, Kaufman J-M, T´Sjoen G. Bone Mass, bone geometry, and body composition in female-to-male transsexual persons after long-term cross-sex hormonal therapy. J Clin Endocrinol Metab. 2012;97:2503-11.
- Emi YA, M; Sasaki, A; Nakamura, Y; Nakatsuka, M. Increased arterial stiffness in female-to-male transsexuals treated with androgen. J Obstet Gynaecol Res. 2008;34:890-7.
- Chandra PB, SS; Chen, TC; Tangpricha, V. Alterations in Lipids and Adipocyte Hormones in Female-to-Male Transsexuals. Int J Endocrinol [serial on the Internet]. 2010.
- Susanne C GE, Gooren LJ, Kronawitter D, Oppelt PG, Beckmann MW, Dittrich R, Mueller A. The impact of testosterone administration to female-to-male transsexuals on insulin resistance and lipid parameters compared with women with polycystic ovary syndrome. Fertility and Sterily. 2010;95(7).
- Spieker LN, G; Lüscher, TF. Therapeutic potential for endothelin receptor antagonists in cardiovascular disorders. Am J Cardiovasc Drugs. 2001;1(293-303).
- Lüscher TN, G. Endothelium dysfunction in the coronary circulation. J Cardiovasc Pharmacol. 1994;24(3):S16-26.
- Polderman KS, CD; van Kamp, GJ; Dekker, GA; Verheugt, FW; Gooren, LJ. Influence of sex hormones on plasma endothelin levels. Ann Intern Med. 1993;118:429-32.
- Ott J KU, Bentz EK, Huber JC, Tempfer CB. Incidence of thrombophilia and venous thrombosis in transsexuals under cross-sex hormone therapy. Fertil Steril. 2010;93(4):1267-72.
- van Kesteren PA, H; Megens, JA; Gooren, LJ. Mortality and morbidity in transsexual subjects treated with cross-sex hormones. Clin Endocrinol (Oxf). 1997;47(3):337-42.
- Asscheman HG, LJG; Eklund, PLE. Mortality and morbidity in transsexual patients with cross-gender hormone treatment. Metabolism. 1989;38:869–73.
- Asscheman H. GG, T´Sjoen M.D., Googren L.J. Morbidity in a Multisite Retrospective Study of Cross-Sex Hormone-Treated Transgender Persons. 2014.
- Valenzuela P SJ. Nanoparticle delivery for transdermal HRT. Nano-medicine. 2012;2012:83-9.
- 40. M G. Are all estrogens created equal? A review of oral vs. transdermal therapy. J Womens Health. 2012;21(2):161-9.
- Gooren LJ KB, Lapauw B, Giltay EJ. (Patho)physiology of cross-sex hormone administration to transexual people: the potential impact of male-female genetic differences. Andrologia. 2015;47:5-19.
- Khosla SM, LJ; Achenbach, SJ; Oberg, AL; Riggs, BL. Hormonal and biochemical determinants of trabecular microstructure at the ultradistal radius in women and men. J Clin Endocrinol Metab. 2006;9(3):885-91.
- Lapauw BT, Y; Simoens, S; Van Caenegem, E; Weyers, S; Goemaere, S; Toye, K; Kaufman, JM; T´Sjoen, G. Body composition, volumentric and areal bone parameters in male-to-female transsexual persons. Bone. 2008;43(6):1016-21.
- Van Caenegem E TY, Wierckx K, Vandewalle S, Toye K, Kaufman J-M, Schreiner T, Haraldsen I, T´Sjoen G. Low bone mass is prevalent in male-to-female transsexual persons before the start of cross-sex hormonal therapy and gonadectomy. Bone. 2013;54:92-7.
- Wiepjes CV, MC; Klaver, M; Nota, NM; de Block, CJM; de Jongh, RT; Lips, P; Heijboer, AC; Fisher, AD; Schreiner, T; T´Sjoen, G; den Heijer, M. Bone mineral density increases in trans personas after one year hormonal treatment: a multicenter prospective observational study2017.
- Van Caenegem E WK, Taes Y, Schreiner T, Vandewalle S, Toye K, Kaufman J-M, T´Sjoen G. Preservation of volumetric bone density and geometry in trans women during cross-sex hormonal therapy: a prospective observational study. Osteoporsis International. 2015;26:35-47.
- Dittrich RB, H; Cupisti, S; Hoffmann, I; Beckmann, MW; Mueller, A. Endocrine treatment of male-to-female transsexuals using gonadotropin-releasing hormone agonist. Exp Clin Endocrinol Diabetes. 2005;113(10):586-92.
- van Kesteren PL, P; Gooren, LJ; Asscheman, H; Megens, J. Long-term follow-up of bone mineral density and bone metabolism in transsexuals treated with cross-sex hormones. Clin Endocrinol (Oxf). 1998;48:347–54.
- Reutrakul SO, B; Piaseu, N; Krittiyawong, S; Chanprasertyothin, S; Bunnag, P; Rajatanavin, R. The effects of oestrogen exposure on bone mass in male to female transsexuals. Clin Endocrinol (Oxf). 1998;49(6):811-4.
- T´Sjoen GW, S; Taes, Y; Lapauw, B; Toye, K; Goemaere, S; Kaufman, JM. Prevalence of low bone mass in relation to estrogen treatment and body composition in male-to-female transsexual persons. J Clin Densitom. 2009;12(3):306-13.
- Ruetsche AK, R; Birkhaeuser, MH; Lippuner, K. Cortical and trabecular bone mineral density in transsexuals after long-term cross-sex hormonal treatment: a cross-sectional study. Osteoporos Int. 2005;16:791-8.
- Miyajima T KY, Oda H. J A study of changes in bone metabolism in cases of gender identity disorder. Bone Miner Metab. 2012;30:468-73.
- Dimitrakakis CB, C. Androgens and the breast. Breast cancer research. 2009;11(5):212.
- Kuroda HO, K; Sakamoto, G, Itoyama, S. Clinicopathological study of breast tissue en female-to-male transsexuals. Surgery today. 2008;38:1067-71.
- Shao T GM, Klein P. Breast cancer in female-to-male transsexuals: Two cases with a review of physiology and management. Clin Breast Cancer. 2011;11:417-9.
- Bentz EP, D; Bilban, M; Kaufmann, U; Helfler, LA; Reinthaller, A; Singer, CF; Huber, JC; Horvat, R; Tempfer, CB. Gene expression signatures of breast tissue before and after cross-sex hormone therapy in female-to-male transsexuals. Fertil Steril. 2010;94(7):2688-96.
- Gooren IJ VTM, Gitay EJ, Van Diest PJ. Breast cancer development in transsexual subjects receiving cross sex hormone treatment. The journal of sexual medicine 2013;10(12):3129-34.
- George R Brown KTJ. Incidence of breast cancer in a cohort of 5135 transgender veterans. Breast Cancer Res Treat. 2015;149: 191-8.
- Gooren IJ VTM, Gitay EJ, Van Diest PJ. Breast cancer development in transsexual subjects receiving cross sex hormone treatment. The journal of sexual medicine. 2013;12(12):3129-34.
- Katayama Y MT, Watanabe S, Miho S, Kimata Y, Matsuoka J, Doihara H, Nanba Y. A very rare case of breast cáncer in a female-to-male transsexual. Breast cancer [serial on the Internet]. 2015.
- Gooren L BM, Lips P, Konings IR. Five new cases of breast cancer in transsexual persons. Andrologia. 2015;47:1202-5.
- Burcombe RM, A; Pittam, M; Finer, N. Breast cancer after bilateral subcutaneous mastectomy in a female-to-male transsexual. Breast. 2003;12(4):290-3.
- Nikolic DV DM, Granic M, Nikolic AT, Stanimirovic VV, Zdravkovic D, Jelic S. Importance of revealing a rare case of breast cancer in a female to male transsexual after bilateral mastectomy2012; 10(280).
- Maglione KD ML, Jaffer S, Szabo J, Schmidt H, Weltz C, Sonnenblick EB. Breast cancer in male-to-female transsexuals: use of breast imaging for detection. Am J Roentgenol. 2014;203(6):735-40.
- Corman V PI, Manto F, Dassy S, Segers K, Thiry A, Bours V, Daly AF, Beckers A. Breast cáncer in male-to-female transexual patient with a BRCA2 mutation. Endocr Relat Cancer. 2016;23(5):391-7.
- M S. Breast cancer in male-to-female transgender patients: A case for caution. Clinical Breast Cancer. 2015;15(1):e67-9.
- Maglione KD ML, Jaffer S, Szabo J, Schmidt H, Weltz C, Sonnenblick EB. Breast cancer in male-to-female transsexuals: Use of breast imaging for detection2014; 203.
- Pattison ST MB. Triple negative breast cancer in a male-to-female transsexual. Internal Medicine Journal [serial on the Internet]. 2013.
- Teoh ZH AD, Gate T. Breast cancer in male-to-female (mtf) transgender patients: Is hormone receptor negativity a feature? BMJ Case Rep [serial on the Internet]. 2015.
- Ito K MY, Suzuki T, McNamara KM, Sasano H. In situ androgen and estrogen biosynthesis in endometrial cancer: focus on androgen actions and intratumoral production. Endocr Relat Cancer. 2016;23(7):R323–R35.
- Watson HF, S; Bonney, RC. Regulation of epidermal growth factor receptor by androgens in human endometrial cells in culture. Hum Reprod. 1998;13(9):2585-91.
- Allen NK, TJ; Dossus, L; Rinaldi, S; Cust, A; Lukanova, A; Peeters, PH; Onland-Moret, NC; Lahmann, PH; Berrino, F; Panico, S; Larrañaga, N; Pera, G; Tormo, MJ; Sánchez, MJ; Ramón, Quirós J; Ardanaz, E; Tjønneland, A; Olsen, A; Chang-Claude, J; Linseisen, J; Schulz, M; Boeing, H; Lundin, E; Palli, D; Overvad, K; Clavel-Chapelon, F; Boutron-Ruault, MC; Bingham, S; Khaw, KT; Bueno-de-Mesquita, HB; Trichopoulou, A; Trichopoulos, D; Naska, A; Tumino, R; Riboli, E; Kaaks, R. Endogenous sex hormones and endometrial cancer risk in women in the European Prospective Investigation into Cancer and Nutrition (EPIC). Endocr Relat Cancer. 2008;15(2):485-97.
- Audet-Walsh E LJ, Grégoire J, Plante M, Caron P, Têtu B, Ayotte P, Brisson J, Villeneuve L, Bélanger A, Guillemette C. Profiling of endogenous estrogens, their precursors, and metabolites in endometrial cancer patients: association with risk and relationship to clinical characteristics. J Clin Endocrinol Metabolism. 2011;96(2):E330–E9.
- Dumesic DA LR. Cancer risk and PCOS. Steroids. Steroids. 2013;78(8):782-5.
- Shen CC YA, Hung JH, Hu LY, Tsai SJ. A nationwide populationbased retrospective cohort study of the risk of uterine, ovarian and breast cancer in women with polycystic ovary syndrome. Oncologist. 2015;20(1):45-9.
- Grynberg MF, R.; Dubost, G.; Colau, JC.; Brémont-Weil, C.; Frydman, R.; Ayoubi, JM. Histology of genital tract and breast tissue after long-term testosterone administration in a female-to-male transsexual population. Reprod Biomed Online. 2010;20:553–58.
- Perrone AC, S; Maria Salfi, NC; Ceccarelli, C; De Giorgi, LB; Formelli, G; Casadio, P; Ghi, T; Pelusi, G; Pelusi, C; Meriggiola, MC. Effect of long-term testosterone administration on the endometrium of female-to-male (FtM) transsexuals. J Sex Med. 2009;6:3193–200.
- Ikeda K BT, Noguchi H, Nagasawa K, Endo T, Kiya T, Saito T. Excessive androgen exposure in female-to-male transsexual persons of reproductive age induces hyperplasia of the ovarian cortex and stroma but not polycystic ovary morphology. Human Reproduction. 2013;28(2):453-61.
- Nakaguma M PT, Gruetzmacher C, Siqueira Cunha F, Palma Sircili MH, Costa EMF, Mendonca BB, Domenice S. Histological effects of long-term androgen therapy in genital tract of female-to-male transseual subjects. 2015.
- Futterweit WD, L. Histopathological effects of exogenosusly administred testosterone in 19 female to male transsexuals. J Clin Endocrinol Metab. 1986;62(1):16-21.
- Chadha SP, TD; Huikeshoven, JM; Brinkmann, AO; Van Der Kwast, TH. Androgen receptor expression in human ovarian and uterine tissue of long-term androgen treated transseual women. Human pathology. 1994;25(11): 1198-204.
- Hage JD, JJ; Karim, RB; Verheijen, RH; Bloemena, E. Ovarian cancer in female-to-male transsexuals: report of two cases. Gynecologic oncology 2000;76(3):413-5.
- Dizo DT-B, T; Koelliker, S; Steinhoff, M; Granai, C. Ovarian cancer associated with testosterone supplementation in a female-to-male transsexual patient. Gynecol Obstet Invest. 2006;62:226-8.
- van Kesteren PM, W; van der Valk, P; Geldof, A; Megens, J; Gooren, L. Effects of estrogens only on the prostates of aging men. J Urol. 1996;156:1349–53.
- Gooren L MA. Prostate cancer incidence in orchidectomised male-tofemale transsexual persons treated with oestrogens. Andrologia. 2014;46:1156–60.
- 86. Turo R JS, Prescott S, Richard Cross W. Metastatic prostate cancer in transsexual diagnosed after three decades of estrogen therapy. Can Urol Assoc J. 2013;7:7-8.
- 87. Spady TP, KL; McComb, RD; Birt, DF; Shull, JD. Estrogen-induced pituitary tumor development in the ACI rat not inhibited by dietary energy restriction. Mol Carcinog. 1999;26:239–53.
- 88. Zafar ME, S; Ramyar, L; Pan, N; Smyth, HS; Asa, SL. Cell-specific expression of estrogen receptor in the human pituitary and its adenomas. J Clin Endocrinol Metab. 1995;80:3621–7.
- 89. salud Md. Atencion de la salud integral de las personas Trans. 2015.

