Vacunación contra VPH. ¿Qué aporta la vacuna nonavalente?
Vaccination against HPV. What does the nonavalent vaccine provide?
Artículo de Revisión
Dra. Laura Fleider
Resumen
Las vacunas contra el VPH se comercializan en Argentina desde el año 2006 y se incluyeron en el Calendario Nacional de Vacunación (CNV) a partir del año 2011. Las primeras vacunas aprobadas por ANMAT fueron la bivalente (2vVPH) que protege contra los tipos 16 y 18 y cuadrivalente (4vVPH) que protege contra los tipos 6, 11, 16 y 18. Actualmente en el CNV está incorporada la vacuna cuadrivalente para todas las niñas de 11 años, nacidas a partir del 1 de enero del año 2000; niños de 11 años nacidos a partir del 1 de enero del 2006 y niñas /niños que convivan con HIV o sean inmunocomprometidos por transplante de órganos sólidos o de células hematopoyéticas.
A partir de noviembre 2022 se encuentra disponible en Argentina la vacuna nonavalente (9vVPH) que protege contra los tipos 6, 11, 16, 18, 31, 33, 45, 52 y 58. Analizaremos que aportes o beneficios nos trae el amplio espectro de protección que otorga esta nueva vacuna.
Palabras clave: Vacuna nonavalente, Virus del Papiloma Humano (VPH), Cáncer de cuello uterino, verrugas genitales, vacunación, vacuna cuadrivalente.
Abstract
HPV Vaccines have been marketed in Argentina since 2006 and have been included in the National Vaccination Calendar (CNV) since 2011. The first vaccines approved by ANMAT were the bivalent (against HPV 16 and 18) and quadrivalent (against HPV 6, 11, 16 and 18). Currently, the CNV incorporates the quadrivalent vaccine for all 11-year-old girls, born on or after January 1, 2000; 11-year-old children born on or after January 1, 2006 and girls/boys who live with HIV or are immunocompromised due to transplant of solid organs or hematopoietic cells.
As of November 2022, the nine-valent vaccine that protects against HPV types 6, 11, 16, 18, 31, 33, 45, 52 and 58 it is available in Argentina. We will analyze what contributions or benefits the broad spectrum of protection that it provides this new vaccine.
Key words: Nonavalent vaccine, Human Papilloma Virus (HPV), Cervical cancer, genital warts, vaccination, quadrivalent vaccine.
Introducción
El VPH, junto a cofactores es el agente etiológico de cánceres, precánceres y patologías benignas en el Tracto Anogenital y Orofaringe de mujeres y hombres.
Son 40 los genotipos que infectan el tracto anogenital, siendo preponderantes los tipos 16 y 18, que se encuentran en aproximadamente el 70% de los cánceres de cuello uterino, seguidos por otros tipos de alto riesgo que en conjunto se encuentran involucrados en aproximadamente el 90% de los cánceres de cuello uterino (1). Dentro de las patologías benignas sabemos que los genotipos 6 y 11 son responsables del 90% de los casos de papilomatosis respiratoria recurrente (PRR) y de las verrugas genitales (VG), cifra que para la Argentina llega al 93.3% (2).
La vacuna nonavalente recombinante fue aprobada por la ANMAT en noviembre de 2018 (3) con indicación para la inmunización activa de mujeres y varones a partir de los 9 años, sin límite superior de edad para la prevención de lesiones precancerosas y cánceres que afectan al cuello de útero, vulva, vagina, ano, papilomatosis laríngea recurrente y verrugas genitales, causados por los tipos de VPH incluidos en la vacuna.
Con respecto a patologías malignas previene contra cinco tipos más que las vacunas existentes. La inclusión de estos genotipos adicionales permite aumentar la protección a casi el 90% de las infecciones por VPH responsables del cáncer cérvico uterino (CCU), el 96% de cáncer anal, el 85 % de cáncer vaginal, el 87% para los cánceres vulvares y también un alto porcentaje de lesiones precancerosas.
Se identificaron alrededor de 200 genotipos de VPH de los cuales 40 infectan el tracto anogenital. Los prevalentes son VPH 6 y 11 que poseen bajo riesgo oncogénico (hallados en verrugas genitales y asociados a infecciones benignas) y VPH 16, 18, 31, 33, 35, 39, 45, 52, 58, 59, 66 y 68, de alto riesgo oncogénico, siendo los VPH 16 y 18 responsables de aproximadamente el 77.9% de los cánceres cervicales en Argentina, según la actualización 2023 del ICO/IARC HPV Information Centre (4).
Según los datos del Programa Nacional de Prevención de Cáncer Cérvicouterino del Ministerio de Salud de la Nación (PNPCCU), éste es el tercer tipo de cáncer más frecuente en la Argentina y continúa siendo un problema significativo de salud pública. En el año 2020 se diagnosticaron 4583 casos y 2553 muertes; siendo el segundo cáncer en incidencia y el primero en mortalidad en las mujeres entre 15 y 44 años (5-6).
Composición de la Vacuna Nonavalente (9vVPH) contra el HPV
El principal reto en el desarrollo de la vacuna 9vVPH fue conseguir una composición que proporcionara una elevada protección frente a la enfermedad asociada a los 5 tipos adicionales de VPH incluidos (31, 33, 45, 52 y 58), sin perder la inmunogenicidad conferida por la vacuna 4vVPH frente a los 4 tipos presentes en su fórmula (6, 11, 16 y 18), y con un perfil de seguridad aceptable. La formulación que cumplió este objetivo fue evaluada en un estudio fase III que permitió confirmar la composición final de la vacuna 9vVPH, que describiremos más adelante.
Como todas las vacunas contra el VPH, se produce por tecnología recombinante. Los viriones nativos del VPH tienen una simetría icosaédrica que consta de 72 pentámeros de proteína L1 con un diámetro aproximado de 60 nm. Para la vacuna, el polipéptido de la cápside L1 de cada uno de los nueve tipos de VPH incluido en la vacuna se expresa en un plásmido (Saccharomyces Cerevisiae), y se autoensamblan para formar la partícula similar al virus (VLP), que imitan la estructura de la cápside de los viriones nativos (Figura 1):
Figura 1. Modelo estructural de una partícula similar al virus VPH7.
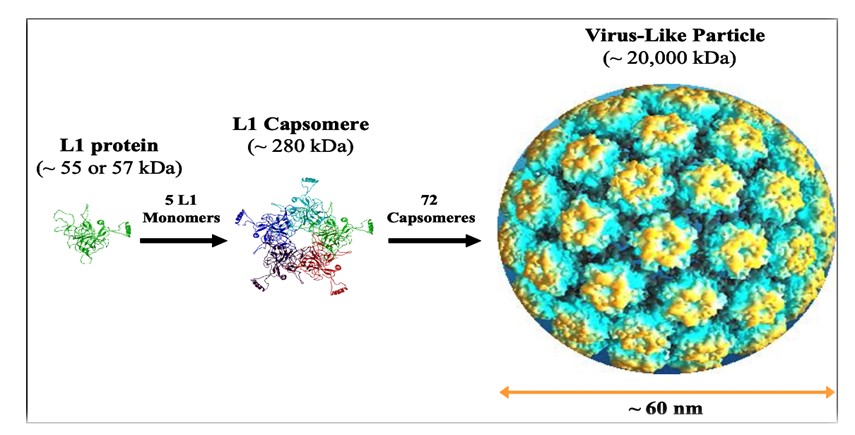
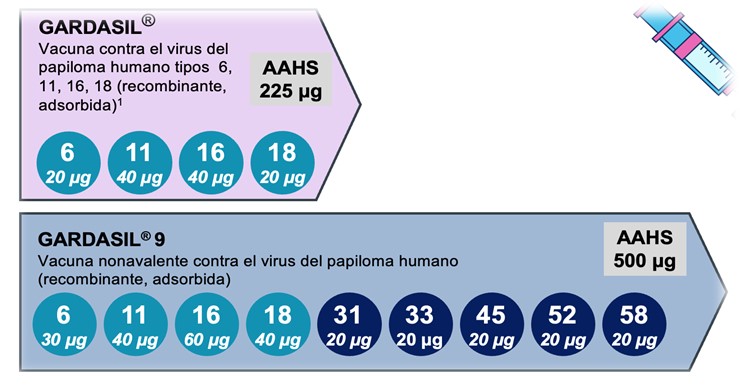
Una dosis de 0,5 ml de la vacuna 9vVPH contiene 30/40/60/40/20/20/20/20/20 g de proteína L1 de los VPH tipo 6/11/16/18/31/33/45/52/58, respectivamente, y 500g de hidroxifosfato sulfato de aluminio amorfo, como adyuvante. Con el fin de tener una adecuada inmunogenicidad debida a la interferencia inmunológica, las dosis incluidas del adyuvante y de algunos antígenos son superiores a las incluidas en la vacuna 4vVPH (Fig. 2).
Figura 2: Diferencias en la composición de las vacunas cuadrivalente y nonavalente
Poblaciones en las que se ha evaluado la vacuna 9vVPH
Los estudios clínicos de la vacuna 9vVPH han incluido niños y niñas entre 9-15 años y mujeres y varones entre 16-26 años. La eficacia en la reducción de infección persistente y CIN2+ se ha demostrado en mujeres entre 16-26 años. En menores de 15 años se estudió la inmunogenicidad mediante estudios de puente inmunológico, para demostrar que al no ser inferiores los anticuerpos en esta población que en mayores de 16 años en quienes se puede medir eficacia contra enfermedad, se obtienen conclusiones válidas8. Los estudios concluyen en resultados de eficacia, independientemente del nivel de anticuerpos circulantes, ya que desconocemos cual es el nivel mínimo de anticuerpos que ofrece eficacia clínica9. Se asume que, con niveles no inferiores de anticuerpos, los datos de eficacia son extrapolables entre ambos grupos.
Dado que éticamente ya no es posible evaluar la eficacia de la vacuna 9vVPH comparándola contra un placebo debido a que la vacunación frente a VPH está ampliamente recomendada por sus beneficios, el programa clínico de la vacuna 9vVPH utilizó como comparador la vacuna 4vVPH10.
Protocolos de desarrollo de la vacuna nonavalente
Protocolo 001 - Determinación de dosis, eficacia, inmunogenicidad, seguridad:
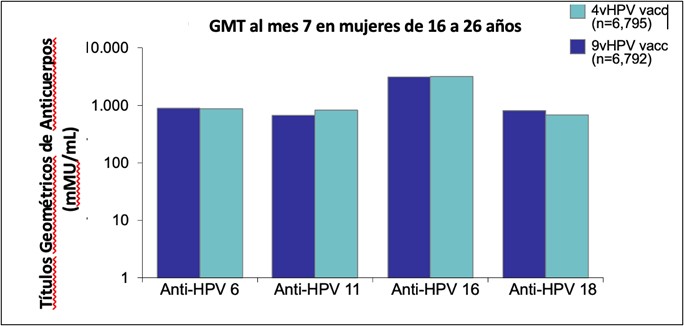
Fue un estudio diseñado para evaluar la eficacia en mujeres de 16 a 26 años. Se incluyeron 14.215 mujeres en un estudio aleatorizado, internacional, doble ciego, de fase IIb-III. Los participantes recibieron la vacuna 9vVPH o la vacuna 4vVPH en una serie de tres inyecciones intramusculares en región deltoidea el día 1 y los meses 2 y 6. Se recolectó suero para el análisis de las respuestas de anticuerpos. Se realizó test de ADN/VPH y citología en base líquida con regularidad. Si alguno fue positivo, se realizó colposcopía con toma de biopsia; el tejido obtenido mediante biopsia o como parte de la terapia definitiva (procedimiento de escisión electroquirúrgica con asa o conización) se analizó para VPH. Se demostró eficacia para la prevención de enfermedad cervical, vaginal y vulvar relacionada a los tipos de VPH incluidos en la vacuna, como así también para la infección persistente. También se observó disminución de Papanicolaou anormales y de procedimientos cervicales. Las respuestas de anticuerpos contra VPH 6, 11, 16 y 18 no fueron inferiores a las generadas por la vacuna 4vVPH (Figura 3). Los eventos adversos relacionados con el lugar de la inyección fueron más comunes en el grupo 9vVPH que en el grupo 4vVPH10-11.
Figura 3: Nivel de anticuerpos anti VPH 6/ 11/ 16/ 18 de la 9vVPH en comparación con la 9vVPH
Protocolo 002 - Extrapolación inmunitaria de adultas a adolescentes:
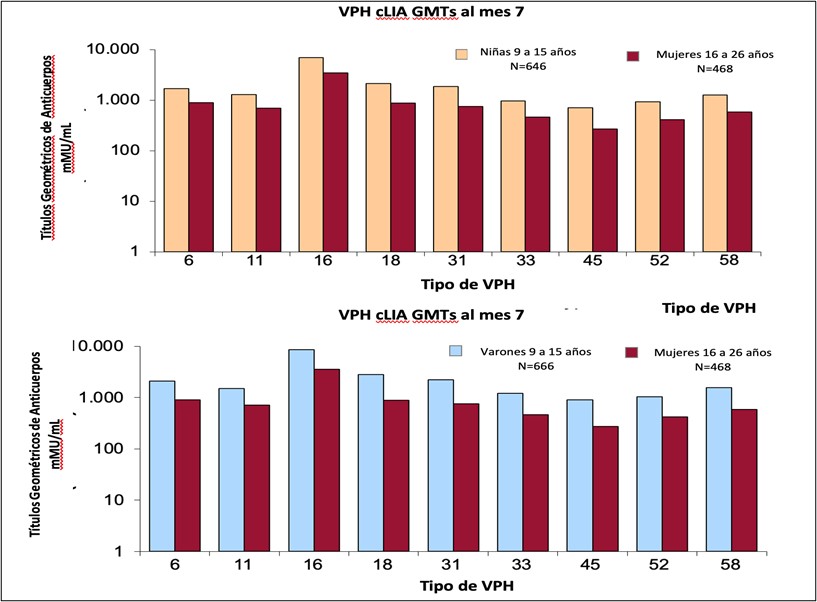
Se trata de un estudio de puente inmunológico de no inferioridad en niñas y niños de 9 a 15 años con respecto a las mujeres de 16 a 26 años, evaluados al séptimo mes luego de recibir tres dosis de la vacuna 9vVPH. Los sujetos (N = 3066) recibieron un régimen de 3 dosis de la vacuna 9vVPH administrada el día 1, el mes 2 y el mes 6. Se realizaron ensayos serológicos anti-VPH el día 1 y el mes 7. Se monitorearon los eventos adversos (EA) sistémicos y en el sitio de inyección y los EA graves. A las 4 semanas después de la dosis 3, >99 % de las niñas, los niños y las mujeres jóvenes seroconvirtieron para cada tipo de VPH de la vacuna. Se obtuvieron aumentos en los títulos medios geométricos para los tipos de VPH 6/11/16/18/31/33/45/52/58 en todos los grupos vacunados. Las respuestas de niñas y niños no fueron inferiores a las de las mujeres jóvenes (Figura 4). En general, la administración de la vacuna 9vVPH fue bien tolerada. Los EA fueron de intensidad leve a moderada (12-13).
Figura 4: Respuesta de anticuerpos en niñas y niños de 9 a 15 años, en comparación con mujeres de 16 a 26 años
Protocolo 003 - Extrapolación inmunitaria de mujeres a hombres:
Este estudio fue diseñado para evaluar la inmunogenicidad y la tolerabilidad de la vacuna profiláctica 9vVPH en hombres jóvenes de 16 a 26 años en comparación con mujeres jóvenes de 16 a 26 años. Se incluyeron 1106 hombres heterosexuales (HH), 313 hombres que tenían relaciones sexuales con hombres (HSH) y 1101 mujeres que aún no habían recibido la vacuna contra el VPH. A todos los sujetos se les administró un régimen de 3 dosis (día 1, mes 2, mes 6) de la vacuna 9vVPH. También se analizó la seguridad. Los títulos medios geométricos (GMT) de anticuerpos para los 9 tipos de VPH incluidos en la vacuna para HH no fueron inferiores a los de las mujeres en el mes 7. Para todos los tipos de VPH de la vacuna, al mes 7 los GMT fueron numéricamente más bajos en HSH que en HH. Más del 99,5 % de los sujetos fueron seropositivos en el mes 7 para cada tipo de VPH de la vacuna (Figura 5). La administración de la vacuna 9vVPH tanto a hombres como a mujeres de 16 a 26 años fue generalmente bien tolerada (14).
Figura 5: Respuesta de anticuerpos en HH y HSH, en comparación con mujeres de 16 a 26 años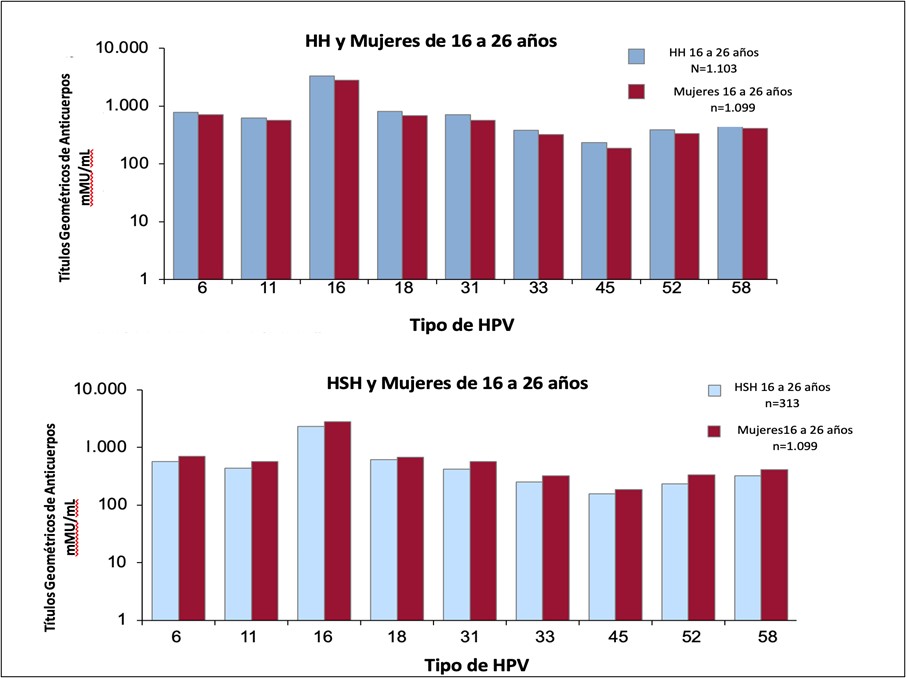
Protocolo 005 – Uso concomitante con Menactraâ, (MCV4; Neisseria meningitidis serotipos A/C/Y/W-135] o Adacelâ [Tdap; acelular contra difteria/tétanos/tos ferina).
Se estudió en niños y niñas de 11 a 15 años comparando la inmunogenicidad y la seguridad de estas vacunas rutinarias en este grupo de edad administradas en forma concomitante en el día 1 (n:621) o no concomitante, en el cual recibieron MCV4/Tdap al mes 1 (n: 620). Se determinaron los anticuerpos contra los antígenos relevantes para VPH, MCV4 y Tdap. Los EA sistémicos y en el lugar de la inyección se monitorearon durante 15 días después de cualquier vacunación y se controlaron los EA graves durante todo el estudio. Los GMT para todos los tipos de VPH en la vacuna 9vHPV 4 semanas después de la dosis 3, los títulos 4 semanas después de la inyección de la vacuna contra la difteria, tétanos y tos ferina c/s poliomielitis no fueron inferiores en el grupo concomitante en comparación con el grupo no concomitante. La hinchazón en el lugar de la inyección ocurrió con más frecuencia en el grupo concomitante y no hubieron EA graves relacionados con la vacuna. Por lo que se concluyó que la administración concomitante de la vacuna 9vHPV con MCV4/Tdap fue generalmente bien tolerada y no interfirió con la respuesta de anticuerpos a ninguna de estas vacunas. Esta estrategia minimizaría el número de visitas requeridas para administrar cada vacuna individualmente (15).
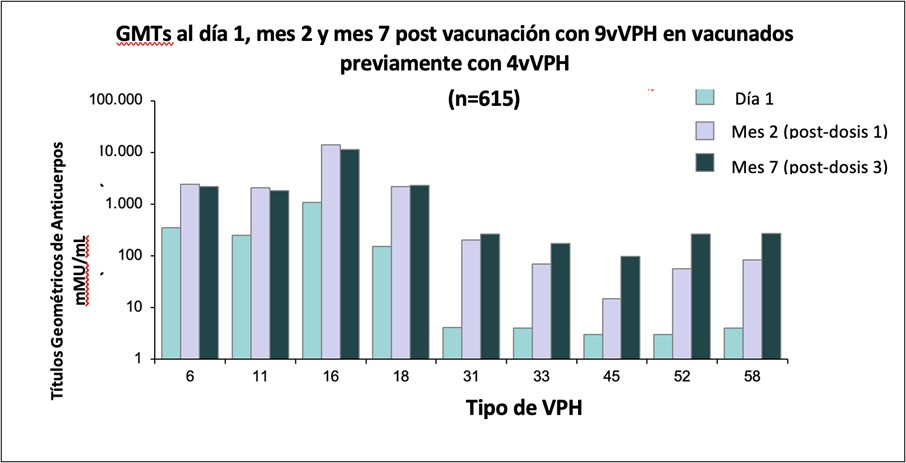
Protocolo 006 - Seguridad e inmunogenicidad en mujeres vacunadas anteriormente con 4vVPH:
Se evaluó la administración de la vacuna 9vVPH en individuos que recibieron previamente la vacuna 4vVPH. Estudio aleatorizado, doble ciego para evaluar la seguridad, tolerabilidad y eficacia de la vacuna 9vVPH en mujeres de 12 a 26 años de edad que fueron vacunadas previamente con la vacuna 4vVPH. Las mujeres incluidas fueron aleatorizadas en una proporción de 2:1 para recibir 3 dosis de la vacuna 9vHPV (n=618) o placebo de solución salina (n=306) en el día 1, mes 2 y mes 6. Se evaluaron los EA locales y sistémicos. Se midieron los títulos de anticuerpos anti VPH 6/11/16/18/31/33/45/52/58 utilizando el inmunoensayo Luminex competitivo (cLIA). A las 4 semanas después de la dosis 3, más del 98 % de los sujetos en el grupo de la vacuna 9vHPV eran seropositivos para los tipos de VPH 31/33/45/52/58, con elevaciones marcadas en los títulos medios geométricos (GMT) de cLIA para estos tipos de VPH.
Los GMT contra los tipos 6, 11, 16 y 18 del VPH mostraron evidencia de una respuesta de memoria inmunitaria en las receptoras anteriores de la vacuna 4vHPV, ya que fueron más altos en las receptoras anteriores de la vacuna 4vHPV que en quienes no estaban vacunadas previamente; a diferencia de la respuesta hacia los 5 nuevos tipos de VPH incluidos en la vacuna 9vVPH que aumentaron exponencialmente en la segunda dosis y siguieron aumentando con la tercer dosis demostrando la existencia de respuesta anamnésica. (Figura 6) (16).
Figura 6: Respuesta de anticuerpos en individuos vacunados previamente con 4vVPH
Protocolo 007 - Uso concomitante con vacuna acelular contra difteria, tétanos, tos ferina y poliomielitis inactivada (Tdap IPV - Repevax®):
En este estudio se evaluó la inmunogenicidad y seguridad de la administración concomitante de ambas vacunas. Estudio abierto, aleatorizado y multicéntrico que incluyó a 1054 hombres y mujeres de 11 a 15 años en una proporción de 1:1. Recibieron una dosis de 0,5 ml de la vacuna 9vHPV por vía intramuscular el día 1, los meses 2 y 6 y una dosis de 0,5 ml de Tdap IPV el día 1 (grupo de vacunación concomitante; n = 526) o el mes 1 (grupo de vacunación no concomitante, n = 528). Las respuestas serológicas para cada componente de la vacuna se evaluaron mediante pruebas de no inferioridad entre los grupos. Se monitorearon los EA sistémicos y en el lugar de la inyección y los EA graves. Las tasas de seroconversión para los tipos de vacuna 9vHPV fueron ≥99,8 % en los grupos concomitante y no concomitante en el mes 7 para todos los tipos de VPH incluidos en la vacuna 9vVPH y para la vacuna Tdap IPV, se estableció la no inferioridad de la respuesta inmunitaria para los antígenos de difteria, tétanos, toda la poliomielitis y tos ferina para ambos grupos. No hubo eventos adversos graves relacionados con la vacuna. Se concluyó que la administración concomitante de la vacuna 9vHPV y Tdap IPV fue generalmente bien tolerada y no interfirió con la respuesta inmunitaria a ninguna de las vacunas. Esta estrategia minimizaría el número de visitas requeridas para administrar cada vacuna individualmente (17).
Protocolo 009 - Extrapolación inmunitaria de 4vVPH a 9vVPH:
En este estudio se comparó la inmunogenicidad y la seguridad de la vacuna 9vHPV versus la vacuna 4vHPV en niñas de 9 a 15 años. Se asignaron 600 participantes al azar para recibir las vacunas 9vVPH o 4vVPH el día 1, el mes 2 y el mes 6. Se realizaron pruebas serológicas el día 1 y el mes 7. Los títulos de anticuerpos específicos (anti-HPV 6/11/16/18/31/33/45/52/58) se determinaron mediante inmunoensayo Luminex competitivo y se expresaron como títulos medios geométricos y tasas de seroconversión. También se evaluó la seguridad de la vacuna. Las respuestas inmunes hacia los VPH 6/11/16/18 provocadas por la vacuna 9vHPV fueron comparables con las provocadas por la vacuna 4vVPH. Las vacunas 9vHPV y 4vHPV mostraron perfiles de seguridad comparables, aunque la incidencia de hinchazón en el lugar de la inyección fue mayor en el grupo de la vacuna 9vHPV13.
En conclusión, luego de analizar detalladamente cada uno de los estudios de investigación vemos en la Tabla I cuales han sido los principales objetivos de los estudios clínicos para el desarrollo de la vacuna 9vVPH:
Tabla I: Objetivos de los estudios clínicos de la vacuna nonavalente
|
TÓPICO |
OBJETIVO |
|
Mujeres (HPV 6, 11, 16, 18) |
Demostrar que brinda un nivel de protección similar al de la vacuna 4vVPH contra infecciones y enfermedades debidas al VPH 6/11/16/18 |
|
Mujeres (HPV 31, 33, 45, 52 y 58) |
Demostrar que brinda un mayor nivel de protección en comparación con la vacuna 4vHPV contra la enfermedad debida al VPH 31/33/45/52/58 |
|
Adolescentes |
Inmunogenicidad no inferior en adolescentes frente a mujeres jóvenes (estudio de puente inmunológico) |
|
Hombres |
Inmunogenicidad no inferior en hombres jóvenes frente a mujeres jóvenes (estudio de puente inmunológico) |
|
Seguridad |
Brindar un perfil de tolerancia y seguridad aceptable |
Por lo cual a continuación remarcamos los puntos de interés en el desarrollo que debemos conocer:
Inmunogenicidad y eficacia contra los tipos 6/11/16/18: En estos estudios clínicos realizados para medir la eficacia de la vacuna 9vHPV en comparación con la vacuna 4vHPV para los tipos de VPH 6/11/16/18, no se utilizó placebo debido a cuestiones éticas, ya que las vacunas contra el VPH son ampliamente recomendadas y están disponibles; por lo que ha sido necesario utilizar un comparador activo (vacuna 4vVPH). Puesto que ambas vacunas son muy eficaces frente a los tipos comunes VPH 6/11/16/18, la incidencia de lesiones de alto grado o de infección persistente relacionadas con estos tipos en los ensayos clínicos fue tan baja que no fue posible realizar comparaciones estadísticas directas para las variables de eficacia entre ambas9. En cuanto a inmunogenicidad, se ha demostrado la no inferioridad de la vacuna 9vVPH vs. la vacuna 4vVPH respecto a la media geométrica de los títulos anti-VPH 6/11/16/18 en mujeres y varones entre 16-26 años, un mes después de la administración de la tercera dosis. Las tasas de seroconversión en la población por protocolo para estos 4 tipos fueron cercanas al 100% para ambas vacunas10-11. En niñas entre 9-15 años, la respuesta inmune para los tipos VPH 6/11/16/18 de la vacuna 9vVPH fue comparable a la de la vacuna 4vVPH después de la administración de la tercera dosis12.
Inmunogenicidad y eficacia contra los tipos 31/33/45/52/58: En un estudio clínico en el cual se incluyeron 14.215 mujeres de 16-26 años, se observó que entre el 99,6- 100% de las mujeres vacunadas con 9vVPH seroconvirtieron para los tipos VPH 31/33/45/52/58 un mes después de la última dosis de la vacuna. En este ensayo clínico se observó una eficacia del 96,7% (IC95%: 80,9-99,8) frente a CIN2/3, VIN 2/3 y VaIN 2/3 asociados a los tipos VPH 31/33/45/52/58 en la población por protocolo. La eficacia frente a la infección persistente (más de 6 meses de duración) causada por estos 5 tipos fue del 96% (IC95%: 94,4- 97,2)11.
Seguridad: En 7 estudios fase III se evaluó el perfil de seguridad (incluyendo más de 15.000 mujeres y hombres entre 9 y 26 años). La vacuna 9vVPH fue generalmente bien tolerada en las poblaciones evaluadas, con un perfil de seguridad similar al de la 4vVPH. Los eventos adversos más comunes (≥5%) con la vacuna 9vHPV fueron en el lugar de la inyección (dolor, hinchazón, eritema) y los sistémicos más frecuentes fueron cefalea y fiebre. Los eventos adversos en el lugar de la inyección fueron más comunes con la vacuna 9vHPV que con la 4vVPH; la mayoría fueron de intensidad leve a moderada. Las discontinuaciones y los eventos adversos graves fueron raros (0,1% y <0,1%, respectivamente). En los ensayos clínicos se informaron siete muertes; ninguno se consideró relacionado con la vacuna. Las proporciones de embarazos con resultados adversos estuvieron dentro de los rangos informados en la población general. En conclusión, la vacuna 9vVPH fue generalmente bien tolerada en sujetos de 9 a 26 años con un perfil de seguridad similar al de la vacuna 4vVPH; Los eventos adversos en el lugar de la inyección fueron más comunes con la vacuna 9vHPV (Figura 7)18.
Figura 7: Seguridad de la 9vVPH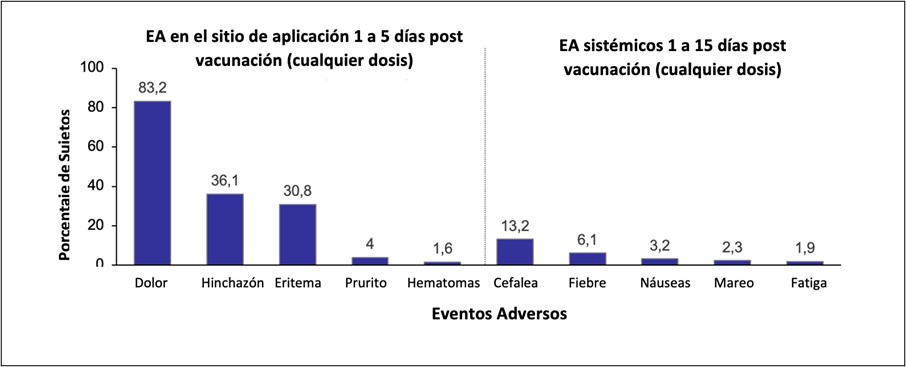
Administración concomitante con otras vacunas del calendario: Se realizaron estudios de administración concomitante y se llegó a la conclusión que la vacuna 9vVPH se puede administrar concomitantemente con las vacunas MenactraÒ, (MCV4; Neisseria meningitidis serotipos A/C/Y/W-135), AdacelÒ [Tdap; acelular contra difteria/tétanos/tos ferina) y Repevax® (Tdap IPV; difteria, tétanos, tos ferina y poliomielitis inactivada), sin observarse interferencia inmunológica entre las vacunas15-17.
Vacunación con 9vVPH de personas previamente vacunadas frente al VPH: Se evaluó la administración de tres dosis de la vacuna 9vVPH a mujeres que hayan recibido el esquema completo de vacunación con la vacuna cuadrivalente, luego de un año de haber completado el esquema de vacunación en mujeres y niñas entre 12-26 años. Se observó un adecuado perfil de tolerabilidad y seguridad. Se demostró una respuesta anamnésica para los tipos de VPH 6/11/16/18 y una respuesta inmunológica robusta para los tipos de VPH 31/33/45/52/58 16.
Embarazo: Como vemos luego de analizar cada protocolo de investigación, no se realizaron estudios específicos de la vacuna 9vVPH en mujeres embarazadas. Motivo por el cual la vacunación con la vacuna 9vHPV debe posponerse hasta la finalización del embarazo. Al haberse utilizado la vacuna 4vVPH como comparador activo durante el desarrollo clínico de la vacuna 9vVPH, se infiere que los tipos de anomalías fetales o la proporción de embarazos con un resultado adverso en las personas que recibieron la vacuna 9vVPH o 4vVPH fueron comparables y consistentes con la población general.
Una gran cantidad de datos sobre mujeres embarazadas (más de 1000 resultados de embarazos) no indican malformaciones ni toxicidad fetal/neonatal de la vacuna 9vHPV.
Esquemas de vacunación y duración de la eficacia
La vacuna 9vVPH debe administrarse en régimen de 2 dosis en personas de 9-14 años (inclusive) en el momento de recibir la primera dosis. La segunda dosis debe administrarse 6 meses después de la primera dosis. Según la ficha técnica de la vacuna 9vVPH de la agencia de salud europea, se recomienda que puede administrarse entre 5-13 meses después de la primera; si se administra antes de 5 meses es preciso administrar una tercera dosis16. Esta pauta fue aprobada por la EMA en febrero del 201619.
El régimen de 3 dosis está indicado para mujeres y varones de 15 años en adelante y en individuos inmunocomprometidos, con un régimen de aplicación de 0, 2 y 6 meses, es decir que la segunda dosis debe recibirse dos meses luego de la primera y la tercera 6 meses luego de la primera. La segunda debe administrarse al menos un mes después de la primera y la tercera al menos 3 meses después de la segunda. Las 3 dosis deben administrarse en el plazo máximo de un año (Tabla 1).
Tabla I: esquema de vacunación con la vacuna nonavalente
|
EDAD 1er DOSIS |
INTERVALO DE ADMINISTRACIÓN |
OBSERVACIONES |
|
9 a 14 años |
0 y 6 meses |
2da dosis entre 5-13 meses después de la 1ra. |
|
. 15 años |
0, 2 y 6 meses |
2da dosis al menos un mes después de la 1ra y la 3ra al menos 3 meses después de la 2da. Tiempo máximo 1 año |
Estas indicaciones surgen de los estudios de investigación. De todas formas debemos conocer que como estas vacunas actúan por respuesta de memoria anamnésica, no debemos reiniciar esquema de vacunación si el tiempo entre la aplicación de las dosis se prolonga aún más que en los estudios desarrollados, ya que en el seguimiento en la vida real se mantiene la eficacia de la vacuna y ya está demostrada la disminución de la incidencia de HSIL cervical relacionada con los 9 tipos de VPH en un 98,2% (CI 95 %, 93,6–99,7) y de cirugía cervical relacionada con los 9 tipos de VPH en un 97,8% (CI 95 %, 93,4–99,4) 20.
Se realizó un estudio para comparar la eficacia de la vacuna en esquema de 2 y 3 dosis 21 en el cual se observó que los GMT de 2 a 2,5 años después de la última dosis en niñas y niños que recibieron 2 dosis fueron generalmente similares o mayores que los GMT en mujeres jóvenes que recibieron 3 dosis. Entre los tipos de VPH, la mayoría de los niños y niñas que recibieron 2 dosis (cLIA: 81 %-100 %; IgG-LIA: 91 %-100 %) y las mujeres jóvenes que recibieron 3 dosis (cLIA: 78 %-98 %; IgG-LIA : 91%-100%) permanecieron seropositivos de 2 a 2,5 años después de la última dosis; concluyendo que las respuestas de anticuerpos generadas por 2 dosis administradas con 6 a 12 meses de diferencia pueden ser suficientes para inducir una eficacia protectora de alto nivel durante al menos 2 años después de la segunda dosis. En los protocolos de investigación se incluyeron mujeres y hombres hasta los 26 años. Por su similitud con la vacuna cuadrivalente FDA en 2018 extendió la aprobación de su aplicación hasta los 45 años, y ANMAT en Argentina, según la disposición 2018 No DI-1018-2088-APN-ANMAT#MSYDS no limita la edad máxima de vacunación22.
El grupo asesor de la Organización Mundial de la Salud (SAGE) consideró la evidencia de una revisión sistemática actualizada sobre la inmunogenicidad, la eficacia y la efectividad de los esquemas de vacunación de dosis única en comparación con los esquemas de vacunación, sin vacunación y multidosis. La revisión incluyó 55 estudios y mostró una eficacia y efectividad comparables entre los esquemas de dosis única y multidosis para prevenir la infección persistente con los tipos 16 y 18 del VPH, con una duración de hasta a 10 años después de la vacunación. Uno de los ensayos clínicos, realizado en Kenia mostró una alta eficacia de una dosis única (97,5 %) en niñas de hasta 20 años. Si bien no existe una correlación de anticuerpos conocida para la protección contra infecciones o enfermedades, los niveles de anticuerpos después de una sola dosis fueron más bajos que en esquemas de dosis múltiples. Sin embargo, permanecieron estables y la seropositividad frente a los VPH 16 y 18 persistió hasta 11 años después de una dosis única. Durante los próximos 3 años, se dispondrá de más evidencia sobre los programas de dosis única de los ensayos de eficacia, incluidos los ensayos cuyos resultados provisionales fueron revisados por SAGE.
El grupo asesor considera que individuos de 15 a 20 años pueden recibir 1 o 2 dosis, mientras que los mayores de 21 años deben recibir 2 dosis con un intervalo de 6 meses. Hasta que haya más evidencia disponible, las personas inmunodeprimidas ≥ 9 años deben recibir al menos 2 dosis e idealmente 3 dosis de la vacuna contra el VPH23.
Por los estudios y similitudes con la vacuna cuadrivalente podemos inferir su eficacia a largo plazo; en lo que respecta a la 9vVPH en el año 2021 se publicó la eficacia a largo plazo en los países nórdicos de Europa con un seguimiento a los 8 años en 2029 participantes de Dinamarca, Noruega y Suecia entre 16 y 26 años que recibieron el 9vVPH durante el estudio de eficacia clínica continuó en el estudio a largo plazo (LTFU: Long Term Follow Up). Se demostró que la eficacia de la vacuna no cae por debajo del 90 %. Estas observaciones muestran que la vacuna 9vVPH se mantiene a los 8 años con un alto nivel de eficacia clínica24.
Vacunación en inmunocomprometidos y en población homosexual
Dada la alta incidencia de cánceres relacionados con el VPH en personas inmunocomprometidas, aquellas que viven con el VIH y niños o adolescentes que enfrentan abuso sexual, SAGE recomienda que estos grupos sean considerados para la vacunación incluso si están fuera del rango de edad elegible estándar.
El VPH tiene una alta carga en las personas que viven con el VIH y los receptores de trasplantes de órganos sólidos debido a la disminución de los recuentos de CD4+ y al tratamiento inmunosupresor, respectivamente. Un metaanálisis informó tasas de incidencia de cánceres relacionados con el VPH que son 6,5 veces mayor para cáncer vaginal y 28,8 veces mayor para cáncer anal en VIH+; y 15,8 veces mayor para cáncer de pene y 22,8 veces mayor para cáncer de vagina en receptoras de trasplante de órgano sólido en comparación con la población general 25.
En un estudio publicado sobre 100 personas infectadas por el VIH (edad: 18-45 años) y 171 receptores de trasplante de riñón, corazón, pulmón (edad: 18-55 años) a los que se administraron 3 dosis de la 9vVPH (0-2-6 meses)26. El resultado primario fue la tasa de seroconversión para cada uno de los tipos de 9vHPV en el mes 7. Los resultados secundarios fueron los GMT y la frecuencia de EA. Se demostró que todos los participantes infectados por el VIH seroconvirtieron para todos los tipos de VPH, mientras que la seroconversión varió del 46 % para el VPH 45 al 72 % para el VPH 58 en receptores de trasplantes de órganos sólidos. Las tasas de seroconversión fueron particularmente bajas en los pacientes con trasplante de pulmón que, por lo general, están más inmunodeprimidos y se tratan con mayor frecuencia con una combinación de tres agentes inmunosupresores en comparación con los receptores de un trasplante de riñón o de corazón. La conclusión fue que la inmunogenicidad de la vacuna 9vVPH es excelente en pacientes con VIH+ pero subóptima en pacientes con trasplante de órgano sólido debido al tratamiento inmunosupresor. Hasta que se disponga de más evidencia en estas poblaciones, la Organización Mundial de la Salud recomienda para los pacientes inmunocomprometidos y/o infectados por el virus de inmunodeficiencia humana una pauta de 3 dosis para las vacunas VPH independientemente de la edad27.
En Canadá, el programa nacional recomienda la vacunación con las vacunas 4vVPH o 9vVPH para población homosexual menores de 27 años28.
Situación actual de vacunación en el Mundo
Las primeras aprobaciones de la vacuna 9vVPH han sido en Estados Unidos por FDA en diciembre de 201429, en Canadá por los servicios de salud en febrero de 201530 y en la Unión Europea por EMA/CHMP en junio 201531, con recomendaciones locales según las autoridades sanitarias de los países miembros. En Argentina fue aprobada por ANMAT en noviembre de 20183.
Hasta marzo de 2022, 117 países habían introducido la vacuna contra el VPH en sus programas nacionales, esto representa sólo un tercio de la población mundial de niñas y el 40% de la carga mundial de cáncer de cuello uterino.
En 2020 la cobertura global estimada con una segunda dosis en las niñas fue sólo del 13% (interrupciones por COVID-19, principalmente cierres de escuelas y escasez de suministros) La Organización Mundial de la Salud insta a todos los países a introducir la vacuna de 9 a 14 años32.
En el mundo para el año 2020, 107 (55%) de los 194 estados miembros de la OMS han introducido la vacunación en Programas Nacionales o en forma parcial33 (Figura 8), en la región de las américas la vacuna ha sido incluida en 44 países y territorios34 (Figura 9)
Figura 8: Introducción de la vacuna contra el VPH en el mundo (junio 2020)
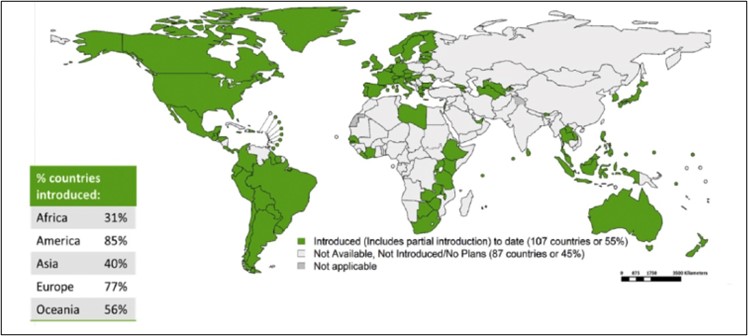
Figura 9: Introducción de la vacuna contra el VPH en la región de las américas (2020)

La incorporación de más países y territorios con alcance a la población vulnerable es un plan estratégico de la Organización Mundial de la Salud para eliminar el cáncer cervical como problema de salud pública35; llevando su incidencia a una tasa umbral de 4 por 100 000 mujeres-año. Para ello las metas para el año 2030 son llamadas 90-70-90 que habrá que alcanzar para 2030 de modo que los países estén bien encaminados hacia la eliminación del cáncer del cuello uterino:
- 90% de las niñas totalmente vacunadas contra el VPH antes de cumplir los 15 años;
- 70% de las mujeres tamizadas mediante una prueba de alta precisión antes de los 35 años y una vez más antes de los 45 años
- 90% de las mujeres diagnosticadas con cáncer o precáncer de cuello uterino tratadas.
Un modelo matemático espera los siguientes beneficios intermedios de lograr las metas 90-70-90 para 2030 en países de ingresos bajos y medianos bajos; los cuales incluyen una disminución de la tasa mediana de incidencia del CCU en un 42% para 2045 y en un 97% para 2120, con lo que se evitarán más de 74 millones de nuevos casos de cáncer del cuello uterino y una cifra acumulativa mediana de muertes por CCU evitadas de 300 000 para 2030, de más de 14 millones para 2070 y de más de 62 millones para 2120.
Conclusiones
Respuestas a Preguntas frecuentes respecto a la Vacuna Nonavalente contra el VPH
- ¿Qué tipos de VPH previene la vacuna 9vVPH?
Es eficaz para prevenir las enfermedades relacionadas con 9 tipos de VPH (VPH 6, 11, 16, 18, 31, 33, 45, 52 y 58)
- ¿Qué patologías previene la vacuna 9vVPH?
Está aprobada para la prevención de cánceres y precánceres de cuello uterino, vulva, vagina, ano, pene, verrugas genitales y papilomatosis laríngea recurrentes vinculada a los tipos de VPH presentes en la vacuna. En estados Unidos a partir del año 2020 está también aprobada para la prevención de cáncer orofaríngeo vinculado a los tipos de VPH presentes en la vacuna 9vVPH.
- ¿cuál es la edad recomendada para el esquema de 2 y de 3 dosis de la vacuna 9vVPH?
La mejor edad para el esquema de 2 dosis es entre los 9 y los 14 años en hombres y mujeres, el esquema de 3 dosis se aplica a partir de los 9 años en la población inmunocomprometida y en mayores de 15 años en la población inmunocompetente.
- ¿se puede aplicar la vacuna 9vVPH en mujeres de mediana edad?
Está aprobado su uso a partir de los 9 años, sin marcar límite de edad.
- ¿es eficaz en hombres y mujeres ya infectados y/o con lesiones previas?
Las personas ya infectadas siempre pueden beneficiarse por la protección para otros tipos de VPH presentes en la vacuna, conociendo que son 40 los tipos de VPH que infectan el tacto anogenital y 9 los presentes en la vacuna; en cuanto a personas con lesiones previas está demostrada la disminución de las recurrencias luego del tratamiento cuando se las vacuna contra el VPH. El mecanismo de esta protección podría ser por disminución de reinfecciones con el mismo tipo de VPH en caso de haber eliminado la infección o de reactivaciones de infecciones latentes en caso de no haberla eliminado.
- ¿es segura la vacuna 9vVPH?
Es tan segura como otras vacunas contra el VPH. No se recomienda vacunar a mujeres embarazadas. Pueden vacunarse mujeres en período de lactancia.
- ¿Puede coadministrarse con otras vacunas del calendario?
Está demostrado que puede administrarse concomitantemente con las vacunas Menactra®, (MCV4; Neisseria meningitidis serotipos A/C/Y/W-135), Adacel® [Tdap; acelular contra difteria/tetanos/tos ferina) y Repevax® (Tdap IPV; difteria, tétanos, tos ferina y poliomielitis inactivada), sin observarse interferencia inmunológica entre las vacunas.
- ¿Pueden vacunarse hombres y mujeres que ya hayan sido vacunados con otras vacunas contra el VPH?
Se puede utilizar la vacuna 9vVPH para continuar o completar la vacunación; para lograr protección completa para los 5 nuevos tipos o para 7 nuevos tipos en el caso de haber sido vacunados con la vacuna bivalente necesitan recibir esquema completo acorde a la edad.
Referencias
- Guan P., Howell-Jones R., Li N., Bruni L y col. Human papillomavirus types in 115,789 HPV-positive women: a meta-analysis from cervical infection to cancer Int J Cancer 2012 15;131(10): 2349-2359.
- Fleider L., Tatti S. y col. Human Papillomavirus Types Involved in External Genital Warts in a Group of Argentinian Women in Buenos Aires JLGTD 2016; 20: 365-366 https://boletin.anmat.gob.ar/Noviembre_2018/Dispo_MSYDS_2088-18.pdf Accesado el 17/4/2022
- Bruni L, Albero G, Serrano B, Mena M, Collado JJ, Gómez D, Muñoz J, Bosch FX, de Sanjosé S. ICO/IARC Information Centre on HPV and Cancer (HPV Information Centre). Human Papillomavirus and Related Diseases in Argentina. Summary Report 10 March 2023. [Date Accessed]
- Ministerio de Salud Argentina Instituto Nacional del Cáncer Estadísticas Incidencia https://www.argentina.gob.ar/salud/instituto-nacional-del-cancer/estadisticas/incidencia
- Ministerio de Salud Argentina Instituto Nacional del Cáncer Estadísticas Mortalidad https://www.argentina.gob.ar/salud/instituto-nacional-del-cancer/estadisticas/mortalidad
- Modis Y, Trus BL, Harrison SC. Atomic model of the papillomavirus capsid. EMBO J. 2002; 16; 21(18): 4754-62. doi: 10.1093/emboj/cdf494. PMID: 12234916; PMCID: PMC126290.
- World Health Organization (WHO). Human papillomavirus vaccines: WHO position paper, October 2014. Wkly Epidemiol Rec. 2014; 89: 465-92.
- Documento de Consenso 2011 de Sociedades Científicas Españolas. Vacunación frente al virus del papiloma humano. Disponible en: http://vacunasaep.org/sites/vacunasaep.org/files/VPH Consenso Sociedades 2011.pdf
- Pitisuttithum P, Velicer C, Luxembourg A. 9-valent HPV vaccine for cancers, pre-cancers and genital warts related to HPV. Expert Rev Vaccines. 2015; 14: 1405-1419.
- Joura EA, Giuliano AR, Iversen OE, Bouchard C, Mao C, Mehlsen J, et al. A 9-valent HPV vaccine against infection and intraepithelial neoplasia in women. N Engl J Med. 2015; 372: 711-723.
- Van Damme P., Olsson S, Block S y col Immunogenicity and Safety of a 9-Valent HPV Vaccine Pediatrics 2015; 36(1):e28-39.
- Vesikari T, Brodszki N, van Damme P y col. A randomized, double-blind, phase III study of the immunogenicity and safety of a 9-valent human papillomavirus L1 virus-like particle vaccine (V503) versus Gardasil® in 9-15-year-old girls. Pediatr Infect Dis J. 2015; 34: 992-998.
- Castellsagué X., Giuliano A., Goldstone S y col. Immunogenicity and safety of the 9-valent HPV vaccine in men Vaccine 2015; 33 (48): 6892-6901
- Schilling A, Macias Parra M, Gutiérrez M y col. Coadministration of a 9-valent human papillomavirus vaccine with meningococcal and Tdap vaccines. Pediatrics. 2015; 136: e563-572.
- Garland SM, Cheung TH, McNeill S y col. Safety and immunogenicity of a 9-valent HPV vaccine in females 12-26 years of age who previously received the quadrivalent HPV vaccine. Vaccine. 2015; 33: 6855-6864.
- Kosalaraksa P, Mehlsen J, Vesikari T y col. An open-label, randomized study of a 9- valent human papillomavirus vaccine given concomitantly with diphtheria, tetanus, pertussis and poliomyelitis vaccines to healthy adolescents 11-15 years of age. Pediatr Infect Dis J. 2015; 34: 627-634.
- Moreira ED Jr, Block SL, Ferris D y col. Safety profile of the 9-valent HPV vaccine: A combined analysis of 7 phase III clinical trials. 2016;138 (2): e20154387.
- Ficha técnica o resumen de las características del producto. Gardasil 9®. Disponible en: https://ec.europa.eu/health/documents/community-register/2015/20150610131761/anx_131761_es.pdf
- Giuliano AR, Joura EA, Garland SM y col. Nine-valent HPV vaccine efficacy against related diseases and definitive therapy: comparison with historic placebo population. Gynecol Oncol. 2019; 154(1):110-117.
- Bornstein J, Roux S, Kjeld Petersen L y col. A. Three-Year Follow-up of 2-Dose Versus 3-Dose HPV Vaccine. Pediatrics. 2021;147(1): e20194035.
- FDA approves expanded use of Gardasil 9 to include individuals 27 through 45 years old https://www.fda.gov/news-events/press-announcements/fda-approves-expanded-use-gardasil-9-include-individuals-27-through-45-years-old
- Weekly Epidemiological Record (WER), 17 June 2022, Vol. 97, No. 24, pp. 261–276
- Kjaer SK, Nygård M, Sundström K y col. Long-term effectiveness of the nine-valent human papillomavirus vaccine in Scandinavian women: interim analysis after 8 years of follow-up. Hum Vaccin Immunother. 2021;17(4): 943-949.
- Grulich AE, van Leeuwen MT, Falster MO, Vajdic CM. Incidence of cancers in people with HIV/AIDS compared with immunosuppressed trans- plant recipients: a meta-analysis. Lancet 2007;370:59–67.
- Boey L, Curinckx A, Roelants M y col. Immunogenicity And Safety Of The Nine-Valent Human Papillomavirus Vaccine In Solid Organ Transplant Re- cipients And Hiv-Infected Adults. Clin Infect Dis 2021, 73 (3): e661–e671
- World Health Organization (WHO). Human papillomavirus vaccines: WHO position paper, October 2014. Wkly Epidemiol Rec. 2014; 89: 465-492.
- Goyette A, Yen GP, Racovitan V y col. Evolution of public health human papillomavirus immunization programs in Canada. Curr Oncol. 2021; 28(1): 991-1007.
- Petrosky E, et al; Centers for Disease Control and Prevention (CDC). MMWR Morb Mortal Wkly Rep. 2015 ;64: 300–304
- Health Canada, Summary basis of Decision Gardasil 9, August 11, 2015: http://www.hc-sc.gc.ca/dhp-mps/prodpharma/sbd-smd/drug-med/sbd_smd_2015_gardasil9_170006-eng.php. Accessed January 19, 2016.
- Gardasil 9: EPAR- Public assessment report. http://www.ema.europa.eu/docs/en_GB/document_library/Summary_of_opinion_-_Initial_authorisation/human/003852/WC500184904.pdf.
- Weekly Epidemiological Record (WER), 16 December 2022, Vol. 97, No 50, 2022, pp. 645–672 https://reliefweb.int/report/world/weekly-epidemiological-record-wer-16-december-2022-vol-97-no-50-2022-pp-645-672-enfr
- Progress towards Global Immunization Goals Updated July 2020 https://cdn.who.int/media/docs/default-source/immunization/global_monitoring/slidesglobalimmunization.pdf
- PAHO Vacuna contra el Virus del Papiloma Humano VPH https://www.paho.org/es/vacuna-contra-virus-papiloma-humano-vph
- Global Strategy to accelerate the elimination of cervical cancer as a public health problem. https://www.who.int/es/publications/i/item/9789240014107
Jefa Sección Patología Cervical del Hospital de Clínicas “José de San Martín” UBA
Doc. Aut. Ginecología UBA
Subdirectora de la Carrera de Médico Especialista en Patologías del Tracto Genital Inferior de la Universidad de Buenos Aires.
Vicepresidenta de la Sociedad Argentina para el Estudio del Virus del Papiloma Humano (SAEVPH)
División Ginecología Hospital de Clínicas “José de San Martín” UBA
Córdoba 2351, C1028 CABA

