Evaluación ultrasonográfica en la diferenciación entre pacientes con telarca precoz y pubertad precoz central
Ultrasonographic evaluation in the differentiation between patients with precocious thelarch and central precocious puberty
Artículo de Revisión
Dr. Roberto E. Gori
Resumen
Uno de los grandes desafíos de los especialistas en Pediatría es diferenciar entre una pubertad precoz central de una incompleta. Se arriba al diagnóstico definitivo de pubertad precoz central cuando ya es imposible realizar un tratamiento de inhibición del eje hipotálamo-hipofisiario. Se han buscado diferentes marcadores de laboratorio, radiológicos y ultrasonográficos, que permitan diferenciar estas dos patologías, pero ninguna es definitiva, ya que presentan diferentes niveles de sensibilidad y especificidad. El gold standard es la prueba de GnRH, la cual no es concluyente. El uso de la radiografía de muñeca izquierda, tomando como referencia de riesgo más de 2DE colabora, pero es insuficiente. El uso de la ultrasonografía es un método económico y sencillo que presenta buenos resultados en manos expertas, siendo los criterios más relevantes los diámetros uterinos y las características del endometrio, existiendo controversias con los volúmenes uterinos y ováricos. El objetivo de la siguiente revisión bibliográfica es determinar cuáles son los criterios ultrasonográficos más sensibles que permitan aproximar el diagnóstico diferencial.
Palabras clave: pubertad normal, pubertad precoz, pubertad precoz central, telarca prematura.
Abstract
One of the great challenges for pediatric specialists is to differentiate between central precocious puberty and incomplete one. A definitive diagnosis of central precocious puberty is reached when it is no longer possible to perform inhibition treatment of the hypothalamic-pituitary axis. A definitive diagnosis of central precocious puberty is reached when it is no longer possible to perform inhibition treatment of the hypothalamic-pituitary axis. Different laboratory, radiological and ultrasonographic markers have been sought to differentiate these two pathologies, but none is definitive, presenting different levels of sensitivity and specificity. The gold standard is the GnRH test, which is inconclusive. The use of left wrist x-ray, taking more than 2SD as a risk reference, helps, but is insufficient. The use of ultrasonography is an economical and simple method, which presents good results in expert hands, the most relevant criteria being uterine diameters and the characteristics of the endometrium, although there are controversies with uterine and ovarian volumes. The objective of the following bibliographic review is to determine the most sensitive ultrasonographic criteria that allow us to approximate the differential diagnosis.
Key words: normal puberty, precocious puberty, central precocious puberty, premature thelarche.
Introducción
Uno de los grandes desafíos que enfrentan pediatras, ginecólogos infantojuveniles y endocrinólogos es diferenciar una pubertad precoz central (PPC), telarca precoz (TP) o pubertad precoz incompleta (PPI) y una adrenarca precoz (AP) cuando consulta una niña de ≤ 8 años con un desarrollo mamario1,2.
La PPC se caracteriza por la activación prematura del eje hipotálamo-hipofisiario-ovárico (HHO), que genera una elevación de estrógenos produciendo un cierre prematuro de los núcleos de osificación dando como resultado una talla final disminuida3-6 y los consecuentes daños psicológicos4-7.
En el caso de TP o PPI, se observan modificaciones mamarias (Tanner anormal), pero sin activación del eje HHO. Por lo tanto, no produce un aumento de estrógenos que afecte a los núcleos de osificación; por ende, no requiere tratamiento.8,9
En el caso de la AP las alteraciones son secundarias al aumento de las hormonas suprarrenales, sin pulsos de GnRH,8,10,11 y es fácil el diagnóstico diferencial con las dos anteriores.
El diagnóstico de la PPC es tardío, ya que los valores de gonadotrofinas y hormonas sexuales en la etapa inicial son similares a los de la TP y la PPI. Complica más el diagnóstico el hecho que el 95% de las PPC son de causa idiopática1,12,13 y solamente un 5% son por ser secundarias a lesiones neurológicas.
Se considera como gold standard a la prueba de GnRH,14-16 pero esta tiene una baja sensibilidad y una alta especificidad,17-19 además de la dificultad técnica para obtener tantas muestras sanguíneas en una menor, debiendo colocarse en muchas ocasiones un catéter.16,17 La evaluación radiológica de la madurez ósea de los huesos de la muñeca también presenta una baja sensibilidad. Cuando son confirmatorias, ya es tardía para un tratamiento eficiente.20-23
También es importante saber que existe una variedad de PPI denominada progresiva.8,24-27 Esta, si bien se comporta inicialmente como una TP, evoluciona a la activación del eje HHO, transformándose en una PPC.
Por todo lo expuesto, se demuestra que, ante la presencia de una telarca en una niña menor a 8 años, no siempre es efectivo basarse solo en la prueba de GnRH y la radiología, ya que sólo detecta a un pequeño grupo de PPC. Otro grupo pasará desapercibido hasta que sea muy tarde.
La conducta de medicar con inhibidores del eje HHO a todas las pacientes con cuadro clínico sospechoso no sólo es éticamente incorrecto, sino que también la administración de estas drogas trae aparejados muchos efectos secundarios. Por este motivo, en las últimas décadas se ha buscado con la ultrasonografía una respuesta, la cual no siempre es definitiva, pero es un buen método de tamizaje.
Evaluación ultrasonográfica
- Valoración de la telarca
La presencia de un aumento del volumen mamario, con o sin palpación de un nódulo retroareolar, requiere una evaluación ultrasónica que permita determinar el desarrollo real o no de la glándula mamaria (telarca vs. pseudotelarca).
La técnica tradicional es correlacionar la clasificación clínica de Tanner con las características ultrasonográficas del botón mamario, las cuales se expresan en el cuadro 1.10,17,18
Cuadro 1. Visualización de las características ultrasonográficas mamarias observadas en cada estadio de Tanner.
|
Tanner |
Características ultrasonográficas |
Visualización |
|
1 |
No se visualiza botón mamario |
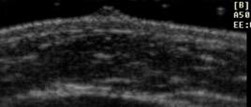 |
|
2 |
Botón mamario que no excede complejo areola-pezón, presenta centro ecogénico |
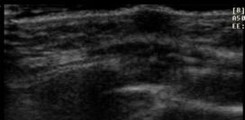 |
|
3 |
Botón mamario: excede complejo areola-pezón. Ídem al Tanner II |
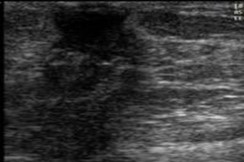 |
|
4 |
Características mamarias del adulto |
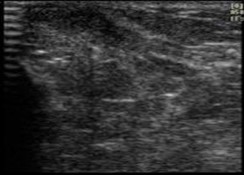 |
Posteriormente, Bruni et al.25 desarrollaron una clasificación complementaria. Al analizar las características, llegaron a la conclusión de que la visualización de los conductos concuerda con la concentración plasmática de estrógenos, expuesta en el Cuadro 2.
Cuadro 2. Diferentes visualizaciones según la acción del estrógeno en la glándula mamaria. Es importante recordar que no es complementaria a la clasificación de Tanner (tomado de Bruni et al. (1990)).
|
Tipos |
Características ultrasonográficas |
Visualización |
|
A |
Sin yemas (sin acción estrogénica) |
 |
|
B |
Aparición de yemas o brotes (escasa exposición a estrógenos) |
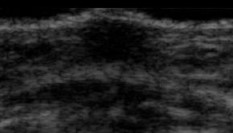 |
|
C |
Yemas con proyección lineal, redondeadas y ecogenicidad distinta a tejido conjuntivo |
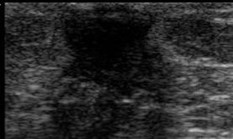 |
|
D |
Formación de conductos periféricos (flechas amarillas) |
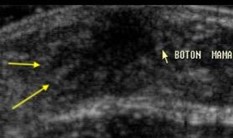 |
|
E |
Forma triangular con ápice en complejo areola-pezón (línea punteada en amarillo) |
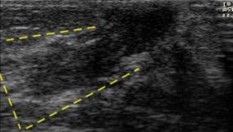 |
Calcaterra et al.23 estudiaron las modificaciones del desarrollo mamario y la concentración de estrógenos en las diferentes situaciones, y sumaron un nuevo concepto, el de “volumen mamario”, que lo obtuvieron multiplicando las tres medidas del botón mamario por una constante (diámetro longitudinal x diámetro transverso x diámetro anteroposterior x 0,523). Del análisis de sus pacientes obtuvieron los percentiles del volumen (Tabla 1).
Tabla 1. Percentiles 25, 50 y 75 del volumen mamario, expresado en centímetros cúbicos(cc), obtenido por la fórmula diámetro longitudinal x diámetro transverso x diámetro anteroposterior x 0,523. Tomado de Calcaterra et al.23
|
Percentil |
Vol. mamario |
|
25 |
0,33 cc |
|
50 |
0,85 cc |
|
75 |
2,21 cc |
Hallaron que el 71,1% de las TP y el 44,7% de las PPC tenían un percentil menor al 50, mientras que tenían un volumen mayor al percentil 50 el 55,93% de las PPC y el 28,8% de las PT. Al utilizar valores mayores de 0,85 cc, como criterio diagnóstico de PPC, obtuvieron una sensibilidad del 66% y una especificidad del 61%.
Si bien los valores de sensibilidad y especificidad fueron bajos, pudieron determinar que los estadios de Tanner no tienen asociación con PPC. No obstante, sí existe una relación directa entre la concentración de estrógenos circulantes y la combinación de los estadios de Bruni más el volumen mamario.
Estudio ultrasonográfico de los órganos pelvianos
Es importante recordar que la vía de exploración ginecológica para investigar las modificaciones producidas por la activación del eje HHO es la transabdominal, el cual requiere un llenado no excesivo de la vejiga. Las vías endocavitaria o transperineal-translabial son complementarias para otras patologías. Se analizarán por separado las modificaciones cualitativas o cuantitativas que puede sufrir el útero, el endometrio y los ovarios.
- Valoración de las características uterinas
Las modificaciones cualitativas que puede sufrir el útero es con respecto a su forma. Esta se obtiene tomando la relación del diámetro anteroposterior de cuerpo uterino (Fu) con respecto al diámetro anteroposterior del cuello (C). Ambas medidas se deben realizar en el eje largo (corte sagital) del útero.
Clásicamente, se define que en la premenarca la relación Fu/C es 1:2 o 1:1,28,29 y una vez activado el eje pasa a 2:130,31 (cuadro 3). Si bien los trabajos iniciales20,32,33 determinaron que esta era un buen método para diferenciar una PPC de TP, posteriormente se vio que no es tan así, dado que, luego de los 7 años, independientemente de su estado hormonal, suele modificarse sin poder diferenciar entre pre y post puberes.30,32,34 Por lo tanto no se puede diferenciar entre PPC y TP.35-37
Cuadro 3. Relación entre diámetro anteroposterior de fondo uterino (Fu) y diámetro anteroposterior de cuello (C). En la prepuberal es 2:1, y luego pasa de 1:1 a 2:1, aunque no siempre respeta estas relaciones. Elaboración propia.
|
Etapa |
Relación Fu/C |
Imagen |
|
Pre puberal |
1:2 |
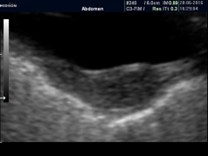 |
|
Post puberal |
2:1 |
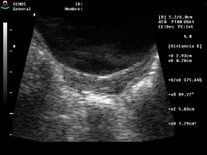 |
.
Cuantitativamente, el útero se estudió analizando sólo el diámetro longitudinal (DL). Otros autores evaluaron el diámetro transverso y, por último, el volumen uterino.
Quizás por su simpleza en obtener la medición la medida más estudiada fue el DL, pero no hay uniformidad en el punto de corte como se representa en la Tabla 2. La sensibilidad para el diagnóstico de PPC es indirectamente proporcional al DL, mientras que la especificidad es directamente proporcional. Por lo tanto, a menor DL utilizado, mayor sensibilidad y menor especificidad. Por ello, la mayoría de los autores al igual que el consenso de 2009 proponen una medida máxima de la normalidad entre 3,4 y 4 cm.18,20, 30,34,38,39
Tabla 2. Punto de corte que permita diferenciar la PPC de la TP a través del diámetro longitudinal del útero (DL), obtención de diferentes valores de sensibilidad (S) y especificidad (E). Elaboración propia.
|
Autor |
DL |
S |
E |
|
de Vries et al 2006 30 |
>34mm |
80,2% |
57,8% |
|
Binay et al 2014 16 |
>30mm |
93% |
86% |
|
Lee et al 2016 14 |
40,9 mm |
33,3% |
79,7% |
|
Kang et al 2010 35 Yu et al 2015 37 |
>22mm |
83,3% |
33% |
Dos autores30,36 proponen utilizar como indicador de activación del eje HHO al diámetro transverso del útero (DT). Reportan una sensibilidad del 67,9%, especificidad del 100%, un valor predictivo positivo de 100% y un valor predictivo negativo de 39,5% cuando el DT es mayor a 15 mm.
Otro gran grupo de autores proponen utilizar como criterio diagnóstico el volumen uterino. Todos utilizaron la misma fórmula (DL x DAP x DT x 0,523), pero diferentes valores (todos constantes independientemente de la edad de la niña) para determinar el riesgo de PPC, que presentan diferentes sensibilidades y especificidades que se expresan en la Tabla 3.
Tabla 3. Valores de sensibilidad (S) y especificidad (E), obtenidos por diferentes autores para el volumen uterino expresado en centímetros cúbicos (cc), obtenidos por la fórmula largo x ancho x alto x 0,523, no por 3D. Elaboración propia.
|
Autores |
Volumen uterino |
S |
E |
|
Haber et al 199533 |
1,8 cc |
100% |
100% |
|
Buzzi et al 199836 |
1,2 cc |
82% |
95% |
|
de Vries et al 200630 |
2 cc |
88,8% |
89,4% |
|
Lee et al 201614 |
3,3 cc |
64,18% |
71,72% |
|
3 cc |
85% |
20,6% |
Calcaterra et al.23 construyeron una tabla de percentilos del volumen uterino sin discriminar edad, donde obtuvieron que el percentil 5 era de 2,39 cc; el 50, de 3,6 cc; y el 75, de 5,73 cc. Tomaron un punto de corte de 5cc y observaron que cuando el volumen era menor a este. El 70% tenían una TP y un 35% eran PPC, pero cuando era mayor se invertía la relación (65% PPC y 30% TP).
Kuczmarski et al.44 recomiendan utilizar un valor variable según edad: de 0 a 6 años, 3,04 cc; y de 6 a 8 años 3,35 cc. Nuevamente surge el mismo criterio: a menor valor de volumen uterino, se obtendrá mayor sensibilidad a expensas de una menor especificidad. El consenso de 200920 propone utilizar como valor de discriminación una variabilidad volumen uterino de 1 a 3 cc, sin discriminar edad.
- Valoración del endometrio:
Se considera que, ante la presencia de un umbral anormal de estrógenos para la edad, el endometrio es visible, lineal y ecogénico, es decir, su valoración es simplemente subjetiva.
El primero en estudiar el endometrio fue Haber et al,33 quien reportó una baja sensibilidad (42%), pero una alta especificidad (100%). Otros estudios30,38 más recientes determinaron que la presencia de un endometrio ecogénico confirma una PPC, pero su ausencia no lo excluye. Calcaterra et al23 en su serie reportaron que la ausencia de visualización de endometrio un 74,29% tenían una TP y un 25% PPC, pero que la relación se invertía cuando era visible (64% tenían PPC y 36% TP) (Cuadro 4).
Cuadro 4. Se puede observar en pacientes con pubertad precoz que el endometrio es hipoecoico (escasa cantidad de estrógenos). En aquellas que presentan gran cantidad de estrógeno (predominantemente en PPC), un endometrio ecogénico; y en ambos casos, la relación Fu/C ≈1. Elaboración propia.
|
No visualización endometrio o hipoecoico |
Endometrio ecogénico |
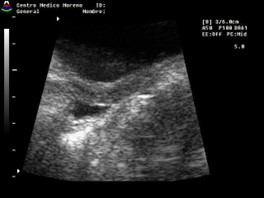 |
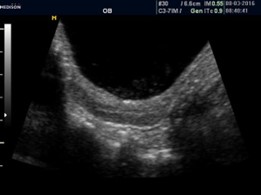 |
- Valoración de los ovarios
Los ovarios fueron evaluados de forma cuantitativa (volumen ovárico) y cualitativa (foliculogénesis).
Volumen ovárico: se interpreta que ante estímulo hormonal (activación del eje HHO), aumenta el tamaño de las gónadas.18, 30, 31, 34-36,40,41 Aun así, la identificación de los ovarios, en especial aquellos que no presentan estructuras funcionales, es dificultosa. Esto genera que, en el caso de ser realizado el estudio por ultrasonografistas no especializadas, informen frecuentemente intestino por ovario.
No existe un criterio único para definir el valor a partir del cual se considera que el volumen ovárico infiere PPC. En las diferentes series, se observaron dos corrientes, una de ellas y la mayoritaria18,23,27,29,33,34,42 utilizaron valores máximos constantes independientemente a la edad de la paciente (Tabla 4). Un solo autor31 propone un valor variable de acuerdo con la edad de la paciente (de 0 a 6 años, 3,04cc; de 6 a 8 años, 3,35cc; y de 8 a 10 años, 4,46 cc).
Tabla 4. Determinación del volumen ovárico máximo de lo normal obtenido por la formula DL x DAP x DT x 0,523 según diferentes autores. Elaboración propia.
|
Autor |
Volumen ovárico máximo |
|
Heber et al33 Herteret al34 |
1 cc |
|
Binay et al16 |
1,3 cc |
|
Stanhope et al43 |
3 cc |
|
Calcaterra et al 23 |
3,52 cc |
|
Griffin et al29 |
4 cc |
El consenso de 200920 no es específico y no propone un valor único. Recomienda usar entre 1 y 3 cc, generando nuevamente la misma disyuntiva: a menor valor, mayor sensibilidad y menor especificidad.
Evaluación de las características ováricas: Venturoli et al.43 clasificaron a los ovarios según sus características en 4 tipos (Cuadro 5): homogéneos sin visualización de folículos, puaciquisticos con < de 6 folículos de menos de 10 mm, multiquísticos con más de 6 folículos de menos de 10mm y macroquísticos con al menos un folículo de más de 10 mm. Es importante comprender que este no es un proceso evolutivo. Por otro lado, la concentración de estrógenos presente en los estadios de Tanner 3 y 4 (que es independiente de la activación o no del GnRH) siempre presentará ovarios multi y/o macroquisticos.34, 38
Diferentes autores30, 34, 31,40, 42 proponen que la presencia de más de 6 folículos infiere PPC, mientras que otros29,36 dicen que no es posible definir con certeza la activación del eje HHO analizando las características ováricas.
Cuadro 5. Tipos de ovarios según clasificación de Venturoli et al43: homogéneo sin folículos (flecha amarilla, difícil de visualizar); pauciquísticos con menos de 6 folículos de menos de 10mm; poliquísticos con más de 6 folículos de menos de 10mm; y macroquísticos, que independientemente del número de folículos, uno al menos mide más de 10 mm (nº1 en amarillo).
|
Tipo ovario |
Características |
Imagen |
|
Homogéneo |
Sin visualización de folículos |
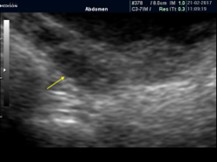 |
|
Pauciquísticos |
Menos de 6 folículos de menos de 10 mm |
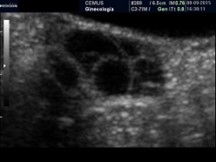 |
|
Multiquísticos |
Más de 6 folículos de menos de 10 mm |
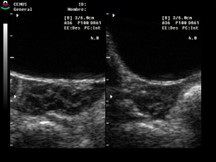 |
|
Macroquísticos |
Al menos un folículo de más de 10 mm |
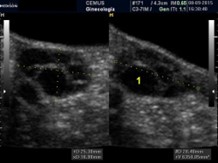 |
Estudio combinado
Si bien eel gold standard del diagnóstico de PPC es la prueba de GnRH, como se ha explicado tiene una buena especificidad (detección de sanos), pero una baja sensibilidad (detección de prueba positiva).
A esto se suma que ningún otro método de laboratorio, radiológico y ultrasonográfico, presenta un criterio único para el diagnóstico, como lo demuestran De Vries et al.30 en el análisis de sensibilidad y especificidad de cada método expuesto en la Tabla 5. Es por ello que el médico tratante deberá conjugar diferentes marcadores para arribar a un diagnóstico.
Tabla 5. Valores estadísticos para cada marcador ultrasonográfico, laboratorio y radiológico (tomado de Vries et al.).30
|
Marcador |
Sensibilidad |
Especificidad |
VPP |
VPN |
|
DT uterino >15 mm |
67,9% |
100% |
100% |
39,5% |
|
DAP Fondo uterino >8mm |
82,5% |
76,4% |
94,2% |
48,1% |
|
DL útero >34 mm |
80,2% |
57,8% |
89% |
40,7% |
|
Volumen uterino >2cc |
88,8% |
89,4% |
97,2% |
65% |
|
Presencia endometrio ecogénico |
57,3% |
100% |
100% |
40,7% |
|
Circunferencia ovárica >4,5 cm |
66,6% |
85,1% |
95,4% |
36,3% |
|
Pico androstenediona>1nmol/l |
59% |
76% |
89% |
35,3% |
|
Pico LH >5 mUI/l |
62% |
93% |
98% |
33,3% |
|
Aumento 2DE edad ósea |
73,3% |
81,8% |
93,2% |
47,3% |
La ultrasonografía pelviana es un método sencillo, económico y con excelente bioseguridad, que permite tamizar población de riesgo. Mejora el diagnóstico cuando se utiliza más de un marcador.
Yu et al37 estudiaron el riesgo de probabilidad positivo (LR+) para cada marcador uterino cuando la prueba de GnRH dio positiva. En su serie, encontró que el marcador más sensible era el DT (LR+ 11,6), seguido por el DAP del útero (LR+5,8), el volumen uterino (LR+ 2,5) y, por último, DL útero, con un LR+ 2,14; por ello, recomiendan, al igual que Buzi et al36, utilizar el diámetro transverso más el volumen uterino.
Por otro lado, Calcaterra et al.23 proponen utilizar como marcadores el volumen uterino y la visualización de un endometrio ecogénico, que presentan baja sensibilidad (55 y 64% respectivamente), pero una mejor especificidad (80 y 74%). En su mismo trabajo, al analizar el bajo resultado estadístico, propone dos modelos multivariables expresados en la Tabla 6, que permiten no solo determinar si se padece PPC, sino también evaluar la PPI evolutiva.
Tabla 6. Evaluación de dos modelos multivariable para determinar PPC, ambos con valores de sensibilidad y especificidad similares. Sumar como criterio de riesgo el volumen mamario no mejora el diagnóstico (tomado de Calcaterra et al.).23
|
Modelo |
Marcadores |
Sensibilidad |
Especificidad |
|
1 |
● Volumen uterino >5cc ● Estradiol ≥ 50pmol/l ● Edad ósea ≥ 2D ● Presencia de endometrio ecogénico |
75% |
85% |
|
2 |
● Volumen uterino >5cc ● Estradiol ≥ 50pmol/l ● Edad ósea ≥ 2D ● Presencia de endometrio ecogénico ● Volumen mamario >0,85 cc |
77% |
83% |
Definió un score que se obtiene en la fórmula expresada en el Cuadro 6. Cuando el resultado obtenido era entre 0 y 2, tenía una baja probabilidad de PPC (11,6%); cuando el valor arrojaba un resultado de entre 2,5 y 4 puntos, presentaba un riesgo intermedio, subiendo la probabilidad de PPC al 42,4% y una PPI o TP del 35%; y cuando el puntaje era de 4,5 a 7 puntos, la probabilidad de una PPC era del 80,3% vs. sólo un 9,1% de TP.
En la actualidad, ningún trabajo recomienda el uso de marcadores biométricos o descriptivos de los ovarios para definir una PPC.
Cuadro 6. Formula de Calcaterra et al,23 donde RPPCP es el riesgo de probabilidad de pubertad central progresiva. Cuando el resultado es de 0-2, es bajo riesgo; 2,5-4, intermedio; y alto, 4,5-7.
|
RIESGO DE RPPCP |
|
|
Marcador |
Puntos |
|
Volumen uterino >5cc |
Si: 0,5 |
|
No: 0 |
|
|
Pico E2>50pmol/l |
Si: 2,5 |
|
No: 0 |
|
|
Edad ósea > 2DE |
Si: 2 |
|
No :0 |
|
|
Endometrio ecogénico |
Si: 0,5 |
|
No: 0 |
|
|
Volumen mamario >0,85cc |
Si: 1,5 |
|
No: 0 |
Consideraciones finales
El diagnóstico diferencial definitivo entre PPC, TP y PPI es tardío, no permitiendo realizar un tratamiento efectivo para la inhibición del eje HHO. El signo de alerta inicial para todas las situaciones es la telarca precoz antes de los 8 años de edad, que debe ser diferenciada de la pseudotelarca por obesidad. La pubarca precoz (vello púbico) es de aparición más tardía, tampoco es exclusivo de la PPC.
El primer estudio solicitado, generalmente, es la ultrasonografía mamaria, pero es imprescindible solicitar, en el mismo momento, una ecografía ginecológica, con la consecuente preparación.
Del análisis inicial de ambas ecografías, es fundamental que la ecografía mamaria informe el Tanner y la clasificación conjunta con la de Bruni, ya que, a partir del Tipo D, infiere alta concentración de estrógenos. En la ultrasonografía ginecológica, se deberá prestar atención a los diámetros uterinos y su volumen (que deben incluir el cuello), como así también las características ultrasonográficas del endometrio.
Si bien la fórmula de Calcaterra et al. expresada en el Cuadro 6 simplifica la orientación de riesgo, es fundamental solicitar el volumen del botón mamario, para en una segunda fase o simultáneamente poder solicitar el pico estrogénico y radiología de muñeca.
Esta propuesta no excluye la solicitud de la prueba de GnRH, pero recordemos que esta es buena para excluir la PPC, con una baja detección de activación del eje, haciendo necesario combinar otros marcadores ultrasónicos.
Bibliografía
- Lee PA. Central precocious puberty. An overview of diagnosis, treatment, and outcome. EndocrinolMetabClin North Am 1999; 28:901-18, xi. doi: 10.1016/s0889-8529(05)70108-0.
- Grumbach MM, Styne DM. Puberty: Ontogeny, neuroendocrinology, physiology, and disorders. In Williams Textbook of Endocrinology (9th ed), Wilson JD, Foster DW, Kronen- berg HM, Larsen PR (eds). W. B. Saunders: Philadelphia, PA, 1998; 1509–1625.
- Kauli R, Galatzer A, Kornreich L, Lazar L, PertzelanA& Laron Z. Final height of girls with central precocious puberty, untreated versus treated with cyproterone acetate or GnRH analogue. A comparative study with reevaluation of predictions by the Bayley- Pinneau method. Hormone Research 1997 47 54–61.
- Brauner R, Adan L, Malandry A &Zantleifer D. Adult height in girls with idiopathic true precocious puberty. Journal of Clinical Endocrinology and Metabolism 1994 79 415–420.
- Carel JC, Lahlou N, Roger M, Chaussain JL. Precocious puberty and statural growth. Hum Reprod Update 2004; 10: 135 – 147. doi: 10.1093/humupd/dmh012.
- Mouridsen, S. E., & Larsen, F. W. (1992). Psychological aspects of precocious puberty: An overview. ActaPaedopsychiatrica: International Journal of Child & Adolescent Psychiatry, 55(1), 45–49.
- Yang JH, Han SW, Yeom CW, Park YJ, Choi WS, Seo JY, et al. Depression and self-concept in girls with perception of pubertal onset. Ann PediatrEndocrinolMetab 2013;18:135-40.
- Stanhope R & Brook CGD. Thelarche variant: A new syndrome of precocious sexual maturation? ActaEndocrinologica (Copenhagen) 1990 123 481–486.
- Saenger P, Dimartino-Nardi J. Premature adrenarche. J Endocrinol Invest 2001; 24: 724 – 733.
- Stanhope R. Premature thelarche: clinical follow-up and indication for treatment. Journal of Clinical Endocrinology and Metabolism 2000 13 (Suppl 1) 827–830.
- Battaglia C, Regnani G, Mancini F, Iughetti L, Bernasconi S, Volpe A, Flamigni C, Venturoli S. Isolated premature pubarche: ultrasonographic and color Doppler analysis a longitudinal study. J ClinEndocrinolMetab. 2002 Jul;87(7):3148-54.
- Merke DP, Cutler GB Jr. Evaluation and management of precocious puberty. Arch Dis Child 1996; 75:269–71.
- Parent AS, Teilmann G, Juul A, Skakkebaek NE, Toppari J, Bourguignon JP. The timing of normal puberty and the age limits of sexual precocity: variations around the world, secular trends, and changes after migration. Endocr Rev 2003;24:668-93.
- Lee SH, Joo EY, Lee JE, Jun YH, Kim MY. The Diagnostic Value of Pelvic Ultrasound in Girls with Central Precocious Puberty. Chonnam Med J. 2016 Jan;52(1):70-4.
- Iughetti L, Predieri B, Ferrari M, Gallo C, Livio L, Milioli S, Forese S, Bernasconi S. Diagnosis of central precocious puberty: endocrine assessment. J PediatrEndocrinolMetab2000; 13 (Suppl 1): 709–715.
- Binay C, Simsek E, Bal C. The correlation between GnRH stimulation testing and obstetric ultrasonographic parameters in precocious puberty. J PediatrEndocrinolMetab. 2014 Nov;27(11-12):1193-9.
- Pescovitz OH, Hench KD, Barnes KM, Loriaux DL & Cutler Jr. Premature thelarche and central precocious puberty: the relationship between clinical presentation and the gonadotropin response to luteinizing hormone-releasing hormone. Journal of Clinical Endocrinology and Metabolism 1988 67 474–479.
- Haber HP, Wollmann HA, Ranke MB. Pelvic ultrasonography: early differentiation between isolated premature thelarche and central precocious puberty. Eur J Pediatr 1995;154:182-6.
- Aritaki S, Takagi A, Someya H, Jun L. Ac omparison of patients with premature thelarche and idiopathic true precocious puberty in the initial stage of illness. ActaPaediatrJpn 1997;39:21-7.
- Carel JC, Eugster EA, Rogol A, Ghizzoni L, Palmert MR; ESPE-LWPES GnRH Analogs Consensus Conference Group, Antoniazzi F, Berenbaum S, Bourguignon JP, Chrousos GP, Coste J, Deal S, de Vries L, Foster C, Heger S, Holland J, Jahnukainen K, Juul A, Kaplowitz P, Lahlou N, Lee MM, Lee P, Merke DP, Neely EK, Oostdijk W, Phillip M, Rosenfield RL, Shulman D, Styne D, Tauber M, Wit JM. Consensus statement on the use of gonadotropin-releasing hormone analogs in children. Pediatrics. 2009 Apr;123(4):e752-62.
- Klein KO, Larmore KA, de Lancey E, Brown JM, Considine RV &Hassink SG. Effect of obesity on estradiol level, and its relationship to leptin, bone maturation, and bone mineral density in children. Journal of Clinical Endocrinology and Metabolism 1998 83 3469–3475.
- DeSimoneM, FarelloG, PalumboM, GentileT, CiuffredaM, Olioso P, Cinque M & De Matteis F. Growth charts, growth velocity and bone development in childhood obesity. International Journal of Obesity and Related Metabolic Disorders 1995 19 851–857.
- Calcaterra V, Sampaolo P, Klersy C, Larizza D, Alfei A, Brizzi V, Beneventi F, Cisternino M. Utility of breast ultrasonography in the diagnostic work-up of precocious puberty and proposal of a prognostic index for identifying girls with rapidly progressive central precocious puberty. Ultrasound Obstet Gynecol. 2009 Jan;33(1):85-91.
- Van Winter JT, Noller KL, Zimmerman D & Melton LJ. Natural history of premature thelarche in Olmsted County, Minnesota, 1940 to 1984. Journal of Pediatrics 1990 116 278–290.
- Bruni V, Dei M, Deligeoroglou E, Innocenti P, Pandimiglio A, Magini A, Bassi F. Breast development in adolescent girls. AdolescPediatrGynecol1990; 3: 201–205.
- Ilicki A, Prager Lewin R, Kauli R, Kaufman H, Schachter A & Laron Z. Premature thelarche - natural history and sex hormone secretion in 68 girls. ActaPaediatricaScandinavica 1984 73 756–762.
- Stanhope R. Gonadotrophin-dependent [correction of dependant] precocious puberty and occult intracranial tumors: which girls should have neuro-imaging? J Pediatr2003; 14: 426 – 427.
- Haber HP, Mayer EI. Ultrasound evaluation of uterine and ovarian size from birth to puberty. PediatrRadiol 1994; 24:11-3.
- Griffin IJ, Cole TJ, Duncan KA, Hollman AS, Donaldson MD. Pelvic ultrasound measurements in normal girls. ActaPaediatr 1995; 84:536-43.
- deVries L, Horev G, Schwartz M, Phillip M. Ultrasonographic and clinical parameters for early differentiation between precocious puberty and premature thelarche. Eur J Endocrinol. 2006 Jun;154(6):891-8.
- Badouraki M, Christoforidis A, Economou I, Dimitriadis AS, Katzos G. Evaluation of pelvic ultrasonography in the diagnosis and differentiation of various forms of sexual precocity in girls. Ultrasound ObstetGynecol 2008;32:819-27.
- Ziereisen F, Guissard G, Damry N, Avni EF. Sonographic imaging of the paediatric female pelvis. EurRadiol 2005;15:1296-309.
- Haber HP, Wollmann HA, Ranke MB. Pelvic ultrasonography: early differentiation between isolated premature thelarche and central precocious puberty. Eur J Pediatr 1995;154:182-6.
- Herter LD, Golendziner E, Flores JA, Moretto M, Di Domenico K, Becker E, Jr & Spritzer PM. Ovarian and uterine findings in pelvic sonography. Comparison between prepubertal girls, girls with isolated thelarche, and girls with central precocious puberty. Journal of Ultrasound in Medicine 2002 21 1237–1246.
- Kang HJ, Nam JS, Cho WK, Cho KS, Park SH, Jung MH, et al. Pelvic ultrasonography findings in girls with precocious puberty. J Korean SocPediatrEndocrinol 2010;15:126-32.
- Buzi F, Pilotta A, Dordoni D, Lombardi A, Zaglio S, Adlard P. Pelvic ultrasonography in normal girls and in girls with pubertal precocity. ActaPaediatr 1998; 87:1138-45.
- Yu J, Shin HY, Lee SH, Kim YS, Kim JH. Usefulness of pelvic ultrasonography for the diagnosis of central precocious puberty in girls. Korean J Pediatr. 2015 Aug;58(8):294-300.
- Lipple BM, Sample WF. Pelvic ultrasonography in pediatric and endocrine adolescent disorders. J Pediatr 1978;92:819–22.
- Bridges NA, Cooke A, Healy MJ, Hindmarsh PC, Brook CG. Growth of the uterus. Arch Dis Child 1996; 75:330–1.
- Sathasivam A, Rosenberg HK, Shapiro S, Wang H, Rapaport R. Pelvic ultrasonography in the evaluation of central precocious puberty: comparison with leuprolide stimulation test. J Pediatr 2011; 159:490-5.
- Battaglia C, Mancini F, Regnani G, Persico N, Iughetti L, De Aloysio D. Pelvic ultrasound and color Doppler findings in different isosexual precocities. Ultrasound ObstetGynecol2003; 22: 277 – 283.
- Stanhope R, Adams J, Jacobs HS, Brook CG. Ovarian ultra- sound assessment in normal children, idiopathic precocious puberty, and during low dose pulsatile gonadotrophin releasing hormone treatment of hypogonadotrophic hypogonadism. Arch Dis Child 1985; 60: 116–119.
- Venturoli S, Porcu E, Fabbri R, et al. Ovaries and menstrual cycles in adolescence. GynecolObstet Invest 1984;17:219–222
- KuczmarskiRJ, Ogden CL &Grummer-Strawn LM. CDC Growth Charts: United States Advanced Data from Vital and Health Statistics NCHS Advance Data Report No. 314, pp 1–27 Hyatsville, MD: US Department of Health and Human Services, 2000.
- Médico especialista Jerarquizado en Ultrasonografía. Past-president y docente de la Sociedad Argentina de Ultrasonografía en Medicina y Biología (SAUMB). Director de CEMUS. Quilmes, Provincia de Buenos Aires, Argentina

