Torsión de ovario y poliquistosis ovárica
Ovarian torsion and polycystic ovary syndrome
Caso Clínico
Gisel Rahman¹, María Inés Salaberry², Betina Pievani³, Eduardo Mazuchelli⁴
Resumen
La torsión de ovario es una causa poco frecuente de dolor abdominal en la infancia y adolescencia. Es considerada una emergencia quirúrgica debido al riesgo de infarto ovárico, en el caso de no restablecerse el flujo sanguíneo frente a la torsión del pedículo vascular. Se presenta el caso de una adolescente de 16 años que consultó por amenorrea secundaria, de 6 meses de evolución, que presentaba una torsión de ovario unilateral, sin síntomas clínicos compatibles, cuya causa identificable fue el aumento del volumen ovárico por síndrome de ovarios poliquísticos.
Palabras clave: torsión ovárica, amenorrea secundaria, adolescente, poliquistosis ovárica
Summary
Ovarian torsion is an uncommon cause of abdominal pain in childhood and adolescence. It is considered a surgical emergency due to the risk of ovarian infarction in case of not reestablishing vascular flow. We present the case of a 16-year-old adolescent who consulted for a 6 month secondary amenorrhea who had an unilateral ovarian torsion. She has no other symptoms. The only identified cause was increased ovarian volume due to polycystic ovary syndrome.
Keywords: ovarian torsion, amenorrhea, adolescent, polycystic ovary syndrome
Introducción
La torsión ovárica es una causa poco frecuente de dolor abdominal en la infancia y adolescencia. Aunque su incidencia actual es desconocida, algunos estudios han reportado 0.3% a 3.5% de casos/año.1 Es considerada una emergencia quirúrgica debido al riesgo de infarto ovárico, en el caso de comprometerse el flujo sanguíneo frente a la torsión del pedículo vascular. El diagnóstico oportuno es importante con el fin de preservar la función ovárica o tubárica y otras morbilidades asociadas. Sin embargo, hacer el diagnóstico constituye un desafío porque los síntomas son relativamente inespecíficos. En la mayoría de los casos, se manifiesta con dolor abdominal (97.5%) asociado con náuseas (67%) o vómitos (62.2%).2 La ecografía es el método complementario de elección en niñas y adolescentes con dolor abdominal y sospecha de torsión ovárica. Como tratamiento debería ofrecerse abordaje laparoscópico con detorsión y conservación ovárica, dada la alta tasa de recuperación y las raras complicaciones.1,3
La poliquistosis ovárica es un trastorno endocrino heterogéneo que frecuentemente empieza a manifestarse en la adolescencia, caracterizado por disfunción ovulatoria e hiperandrogenismo.4 En la adolescencia tiene una prevalencia variable según el criterio diagnóstico que se utilice; se reportan cifras de 11.04% (Rotherdam), 3.39% (National Institute of Health) y 8.03% (Androgen Excess Society).5 El diagnóstico no es sencillo en la adolescencia, porque hay superposición con eventos fisiológicos.6
Se presenta el caso de una adolescente de 16 años que consultó por amenorrea secundaria de 6 meses de evolución, que presentaba una torsión de ovario unilateral, sin síntomas clínicos compatibles, cuya causa identificable fue el aumento del volumen ovárico por síndrome de ovarios poliquísticos (SOP).
Consideraciones éticas
Se solicitó el consentimiento informado de la adolescente para la publicación del caso. Los datos han sido anonimizados.
Descripción del Caso Clínico
Paciente de 16 años que consultó por presentar amenorrea secundaria de 6 meses de evolución. Había presentado su menarca a los 13 años, refería ciclos irregulares (mayores de 38 días), con episodios de sangrado menstrual excesivo, y en una ocasión amenorrea de 4 meses. No había iniciado relaciones sexuales.
En la evaluación física al momento de la consulta, se registró un peso 68.5 kg, talla de 166 cm e índice de masa corporal (IMC) de 24.8 kg/m2. Presentaba un examen mamario en estadio IV de Tanner, con escasa turgencia, abdomen blando, depresible e indoloro, vulva trófica, himen presente, aumento de vello en mentón, línea alba y tercio inferior de la espalda (Ferriman Gallwey: 7), y circunferencia de cintura de 88 cm.
Los estudios complementarios mostraron los siguientes resultados:
Ecografía ginecológica suprapúbica: informa útero en anteroversión (AVF); de forma, tamaño y ecoestructura normal (diámetro longitudinal [DL]: 76 mm, diámetro anteroposterior [DAP]: 20 mm, diámetro transversal [DT]: 43 mm); eco endometrial central de 5 mm; ovario izquierdo ligeramente aumentado de tamaño, de 44 mm x 28 mm x 22 mm (volumen 14 cc); ovario derecho aumentado de tamaño y de forma esférica, sin evidencia de imágenes quísticas de aspecto patológico, de 72 mm x 57 mm x 39 mm (volumen 83 cc); fondo de saco de Douglas libre. Se sugieren estudios de mayor complejidad y laboratorio.
Laboratorio: hematocrito 33%, hemoglobina 11 g/dl, eritrocitos 3 930 000/µl, leucocitos 5370/µl, glucemia 0.68 g/l, hepatograma normal, urea 19 g/l, creatinina 0.75 mg/dl, ácido úrico 3.6 mg/dl, perfil lipídico normal, coagulograma normal, hormona luteinizante (LH) 8.82 mU/ml, hormona foliculoestimulante (FSH) 6.19 mU/ml, prolactina (PRL) 16.7 ng/ml, estradiol 47 pg/ml, testosterona libre 7.9 pg/ml, androstenediona 2.7 mg/ml, deshidroepiandrosterona (DHEAS) 211 ng/ml, 17-hidroxiprogesterona 1.6 ng/ml, insulinemia 9.3 µU/ml, tirotropina (TSH) 2.14 µU/ml, T4L 1.09 ng/dl, anticuerpos antitiroideos negativos.
Dado el aumento de tamaño ovárico y la ausencia de otros datos ecográficos, se solicitan marcadores tumorales y resonancia magnética (RM) de alta resolución de pelvis con contraste.
Marcadores tumorales: gonadotropina coriónica humana (HCG) subβ: < 0.2 mUI/ml, alfafetoproteínas: < 0.91 ng/ml, CA 19/9: 4.39 U/ml, CA 15/3: 9.25 U/ml, CA125: 17.20 U/ml, antígeno carcinoembrionario (CEA): 1.32 ng/ml, todos dentro de límites normales para la edad.
Resonancia magnética: de pelvis de alta resolución, con cortes de 3 mm de espesor en planos axial, coronal y sagital, empleando secuencias ponderadas en T2 y T1 pre- y poscontraste endovenoso, y sagital T1 FAT SAT poscontraste, con localización de 3 planos previos. Se implementaron secuencias para la ponderación de los tiempos de relajación T1 en cortes axiales de 8 mm y coronal T2 FAT SAT de 7 mm de espesor. Las imágenes se registraron con cámara láser. Se identifica el aumento de volumen del ovario derecho (volumen: 68 cm3 y diámetros 6.7 cm x 4 cm x 4.9 cm), centralizado en la línea media, que muestra cambios en su morfología, con distribución periférica de los folículos antrales; a nivel central del ovario se presenta hiperintensidad de secuencia T2 FS, que sugiere edema estromal. Como dato relevante, se identifica signo del remolino, hallazgo compatible con torsión ovárica. El ovario izquierdo presenta más de 10 folículos de tipo antrales, que promedian entre 6 mm y 10 mm, y volumen ovárico de 19 cm3, con diámetros de 4.6 cm x 2.7 cm x 3 cm, compatible con poliquistosis ovárica. El útero se encuentra en anteversión de morfología conservada. Mínima cantidad de líquido libre perianexial. Vejiga urinaria parcialmente distendida, de paredes delgadas. Recto, planos grasos perivesicales y perirrectales sin particularidades. No se identifican adenopatías pélvicas (Figuras 1, 2 y 3).
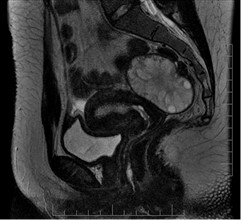
Figura 1. Resonancia magnética; corte sagital secuencia T2: útero en AVF; ovario derecho localizado por detrás, en la línea media, aumentado de tamaño, con aumento de su intensidad atribuible a edema. Quistes antrales de distribución periférica.
AVF, anteroversión.
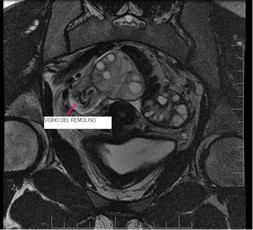
Figura 2. Corte coronal secuencia T2; se observa el signo del remolino: torsión del íleo vascular derecho. Ovario derecho con aumento de su señal atribuible a edema, ubicado en la línea media.
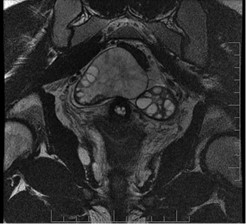
Figura 3. Corte coronal secuencia T2: Se observan ambos ovarios.
Ante el diagnóstico de sospecha de torsión ovárica, se decidió internación y resolución quirúrgica inmediata. Se realizó abordaje por laparoscopia, en la que se observaron ovarios poliquísticos, con engrosamiento de la corteza con múltiples folículos, aumentados de tamaño y con dilataciones tubáricas congestivas bilaterales. Del lado derecho se puso de manifiesto pseudotorsión infundibular, que se destorsionó; se realizó pexia al ligamento redondo.
Ante la dilatación tubárica, se indicó tratamiento empírico para enfermedad pelviana inflamatoria con ceftriaxona 250 mg intramuscular, doxicilina 100 mg cada 12 h y metronidazol 500 mg cada 12 h por 14 días. Se realizó cultivo que resultó negativo; no se detectó Chlamydia trachomatis (reacción en cadena de la polimerasa [PCR]), Mycoplasma o Ureaplasma.
En el seguimiento se indicó tratamiento con anticonceptivos orales combinados, con etinilestradiol 0.030 mg y drospirenona 3 mg, con buena evolución. Se realizó ecografía de control, con disminución del volumen ovárico y adecuada perfusión puesta en evidencia con Doppler color.
Discusión
El ovario no se encuentra fijo, y puede colocarse lateral o posterior al útero. Se encuentra suspendido por el ligamento infundibulopélvico, que lo une a la pared lateral pélvica, dentro del cual transcurren los vasos del ovario. Otras estructuras de soporte del ovario incluyen el ligamento útero-ovárico y el mesovario, un área del ligamento ancho. Cuando el ovario se torsiona, gira alrededor del ligamento infundibulopélvico y el ligamento útero-ovárico; a menudo, también la trompa de Falopio está involucrada, y cuando esto ocurre se denomina torsión anexial.
La torsión de ovario se presenta en la mayoría de los casos con dolor abdominal, entre el 97.5% y 100% de las pacientes en los trabajos de revisión.1,2 En el presente caso, la paciente no presentó dolor agudo ni tuvo los síntomas asociados descritos más frecuentemente.
La presencia de una masa en el ovario, al aumentar el volumen y el tamaño ováricos, hace que sea más probable que este gire sobre el eje de los ligamentos fijándose en una posición.1 La torsión puede ocurrir en ovarios de tamaño normal, probablemente por una elongación del ligamento infundibulopélvico, pero más frecuentemente ocurre ante la presencia de quistes o neoplasias, en general benignas más que malignas, pues estas últimas tiene tendencia de estar fijadas.7,8 El mecanismo de torsión de los ovarios en mujeres y niñas con masas ováricas se relaciona con el aumento de tamaño y peso del ovario involucrado, actuando este como punto de apoyo para la torsión.9 En el caso de nuestra paciente, no había ninguna tumoración que justificara la torsión, pero sí aumento del volumen ovárico (considerando el tamaño que presentaba el contralateral) que podría hacerlo. En la literatura se describen muy pocos casos de torsión asociada con la poliquistosis ovárica, como en nuestra paciente.10-12
La torsión anexial es en general más frecuente del lado derecho, probablemente porque el ligamento útero ovárico de este lado es más largo que el izquierdo, o bien la presencia del sigmoides ayudaría a prevenirla del lado contralateral.13 La torsión ocurrió en este paciente del lado derecho, localización más frecuentemente descrita en la literatura.1,2,13
La rotación del ligamento infundibulopélvico causa compresión de los vasos ováricos e impide el drenaje linfático y venoso y la entrada arterial. Al inicio del cuadro, el suministro arterial al ovario no se interrumpe en el mismo grado que el drenaje venoso, ya que las arterias musculares son menos compresibles que las paredes delgadas de las venas. La perfusión arterial continúa y el flujo de salida está bloqueado, lo que genera edema del ovario con aumento marcado del volumen ovárico y mayor compresión vascular. Entonces, ocurre isquemia ovárica y puede resultar en necrosis ovárica, infarto y hemorragia local.13 Esta situación explicaría el aumento del volumen del ovario comprometido y la preservación de su vitalidad; si no se hubiese intervenido, posiblemente la evolución podría haber generado la pérdida de este.
La ecografía es el método complementario más adecuado para el diagnóstico de esta entidad dado que permite, con la ventana acústica vesical, una adecuada visualización, no se irradia a la paciente y permite evaluar clínicamente la sensibilidad focal con la presión del transductor aplicada sobre el área comprometida, dato semiológico posible solo con este método.9 El aumento del tamaño ovárico, la distribución periférica de folículos, la localización anormal del anexo en relación con el útero y la presencia de líquido libre constituyen hallazgos ecográficos sugestivos de torsión anexial. Puede manifestarse ausencia del flujo arterial por Doppler, pero no siempre está presente porque se afecta primero el flujo venoso y linfático.1 La tomografía computarizada anexial o la RM se solicitan solo si lo hallazgos no son concluyentes o en presentaciones atípicas.9 El diagnóstico se definió por una RM solicitada ante un aumento de volumen ovárico, con una imagen ecográfica no definitoria de etiología.
El hidrosalpinx ocurre cuando una trompa de Falopio es bloqueada distalmente y se llena de líquido. La trompa obstruida puede estar sustancialmente dilatada y puede acumularse dentro líquido seroso, sangre o pus, según la causa de la obstrucción. Puede ocurrir como una lesión anexial aislada o como el componente de una lesión anexial compleja. La causa más frecuente de oclusión tubárica es la enfermedad pelviana inflamatoria. Otras causas incluyen endometriosis, adherencias tubáricas por cirugía previa, cáncer de trompa y embarazo ectópico tubario.14 El hidrosalpinx no es un diagnóstico común en adolescentes posmenárquicas sin inicio de actividad sexual. Las causas descritas en la literatura se relacionan con antecedente de cirugías abdominales, y las adherencias posquirúrgicas serían el principal factor predisponente para la obstrucción tubárica y el subsecuente desarrollo de hidrosalpinx.15 Se han reportado en la bibliografía casos en esta población de torsión tubárica como consecuencia de hidrosalpinx.16 La torsión de la trompa de Falopio asociada con hidrosalpinx se informan en aproximadamente el 9% de las torsiones anexiales, difícil de diferenciar del hidrosalpinx por enfermedad pelviana inflamatoria en las imágenes.9 Esto explicaría el hallazgo del hidrosalpinx en este caso clínico, sin inicio de relaciones sexuales. Hecho el diagnóstico de hidrosalpinx y dada su asociación con la enfermedad pelviana inflamatoria, el tratamiento antibiótico empírico podría ser beneficioso.15
El SOP es la causa más común de infertilidad en la mujer. Frecuentemente comienza a manifestarse durante la adolescencia y se caracteriza por disfunción ovulatoria e hiperandrogenismo. El diagnóstico tiene relevancia dado el aumento de riesgo de síndrome metabólico, diabetes tipo 2 y la posibilidad de enfermedad cardiovascular y carcinoma de endometrio a lo largo de la vida.17 Los criterios de diagnóstico de SOP utilizados en las mujeres adultas no se ajustan a las adolescentes, debido a que:18
- Los ciclos anovulatorios y la irregularidad menstrual son frecuentes en adolescentes sanas.
- Los signos clínicos de hiperandrogenismo son menos confiables en las adolescentes porque el hirsutismo se encuentra en una fase de desarrollo y el acné vulgar es común.
- La medición de las concentraciones séricas aumenta durante los ciclos anovulatorios, no hay valores ni pruebas estandarizadas para la valoración de andrógenos en esta etapa y no está claro hasta qué punto el hiperandrogenismo adolescente predice el hiperandrogenismo del adulto.
- La morfología de los ovarios poliquísticos, según los estándares de los adultos, es frecuente en adolescentes normales.
Se sugiere, para su diagnóstico en la adolescencia, utilizar los criterios diagnósticos propuestos por el National Institute of Health (NIH) para mujeres adultas, adaptados a la edad ginecológica (Tabla 1).
|
Combinación que no puede ser explicada por otra causa de: |
|
1. Patrón menstrual anormal como evidencia de disfunción ovulatoria: |
|
A. Anormal para la edad o la edad ginecológica, y B. Síntomas persistentes durante 1 a 2 años. |
|
2. Evidencia clínica o bioquímica de hiperandrogenismo: |
|
A. El hirsutismo, especialmente si es de moderado a grave, es evidencia clínica de hiperandrogenismo. B. La elevación de la testosterona total o libre sérica, medida por un ensayo de referencia especializado, es evidencia bioquímica de hiperandrogenismo. |
Tabla 1. Criterios de diagnóstico de consenso internacional para el síndrome de ovarios poliquísticos en adolescentes.
Extraído de: Perspectives on the International Recommendations for the Diagnosis and Treatment of Polycystic Ovary Syndrome in Adolescence. J Pediatr Adolesc Gynecol 2020; 33(5): 445-447.19
El aumento de las gonadotrofinas incrementa el volumen ovárico y el desarrollo folicular, otorgando la apariencia multifolicular del ovario en las adolescentes. Según las guías internacionales de evaluación y manejo del SOP basadas en la evidencia, la correlación entre la función menstrual y la morfología del ovario poliquístico, según los criterios de Rotterdam, no estaría clara en los 2-4 años posmenarca, en los que la presencia de estas características en el ovario sería común.20 No se recomienda usar la ecografía para el diagnóstico de SOP antes de los 8 años de edad ginecológica.19,20 En pacientes jóvenes que presentan características de SOP, incluido volumen ovárico aumentado, se requiere un cuidadoso seguimiento.21
Algunos estudios han demostrado la superioridad de la RM por sobre la ecografía abdominal para el diagnóstico morfológico del SOP en las adolescentes, ya que definiría el volumen ovárico y permitiría individualizar el número de folículos, sobre todo en pacientes obesas, ya que en este grupo difícilmente podríamos utilizar la ecografía intravaginal si no han iniciado relaciones sexuales. Aunque la RM es más costosa, podría permitir una mejor detección de los ovarios con características poliquísticas.22,23 Deberían estandarizarse los parámetros que definen la morfología, dado que las apreciaciones por la ecografía y la RM en las mismas pacientes arrojan diferentes resultados por el detalle y la precisión aportados por la última. En el presente caso, se solicitó la RM ante la falta de datos de la ecografía, y se determinó tanto la etiología del aumento del volumen ovárico como de la morfología poliquística de los ovarios.
La evidencia avala como tratamiento para la torsión de ovario la detorsión y no la ooforectomía, dado que la primera se considera un procedimiento seguro. La mayoría de los ovarios detorsionados han conservado su vitalidad.1,3,13 La pexia del ovario para prevenir la recidiva podría ser beneficiosa.3 En el caso de la paciente, se optó por la detorsión y pexia, con buenos resultados.
El tratamiento de primera línea en las adolescentes para la alteración del ciclo menstrual y el hirsutismo es el uso de anticonceptivos orales combinados, y asociar medidas higiénico-dietarias en caso de obesidad y alteraciones metabólicas, junto con el uso de metformina.19 Se indicaron anticonceptivos orales combinados –etinilestradiol y drospirenona– con la finalidad de regularizar los ciclos.
Se comunica este caso por el hecho infrecuente de torsión ovárica de presentación asintomática, cuya causa identificable fue el aumento del volumen ovárico dado por la poliquistosis ovárica.
Referencias
- Adeyemi-Fowode O, Lin EG, Syed F y col. Adnexal torsion in children and adolescents: a retrospective review of 245 cases at a single institution. J Pediatr Adolesc Gynecol 2019; 32(1): 64-69.
- Rey-Bellet Gasser C, Gehri M, Joseph JM, Pauchard JY. Is it ovarian torsion? A systematic literature review and evaluation of prediction signs. Pediatr Emerg Care 2016; 32(4): 256-261.
- Dasgupta R, Renaud E, Goldin AB y col. Ovarian torsion in pediatric and adolescent patients: A systematic review. J Pediatr Surg 2018; 53(7): 1387-1391.
- Witchel SF, Oberfield SE, Peña AS. Polycystic ovary syndrome: pathophysiology, presentation, and treatment with emphasis on adolescent girls. J Endocr Soc 2019; 3(8): 1545-1573.
- Naz MSG, Tehrani FR, Majd HA y col. The prevalence of polycystic ovary syndrome in adolescents: A systematic review and meta-analysis. Int J Reprod Biomed 2019; 17(8): 533-542.
- Espinoza Flores MT, Saavedra Belmonte J, Mostajo Flores D. Hiperandrogernismo en la infancia y adolescencia: enfoque fisiopatológico para el diagnóstico. En: Endocrinología ginecológica. Inés de la Parra y col. 1ª ed. Buenos Aires: Journal; 2013.
- Houry D, Abbott JT. Ovarian torsion: a fifteen-year review. Ann Emerg Med 2001; 38(2): 156-159.
- White M, Stella J. Ovarian torsion: 10-year perspective. Emerg Med Australas 2005; 17(3): 231-237.
- Ngo AV, Otjen JP, Parisi MT y col. Pediatric ovarian torsion: a pictorial review. Pediatr Radiol 2015; 45(12): 1845-1844.
- Shah AA, Likes CE, Price TM. Early polycystic ovary syndrome as a possible etiology of unexplained premenarcheal ovarian torsion. J Pediatr Adolesc Gynecol 2009; 22(4): 265-269.
- Olufowobi O, Sorinola O, Afnan M y col. Spontaneous disappearance of a normal adnexa associated with a contralateral polycystic-appearing ovary. Obstet Gynecol 2002; 100(5 Pt 2): 1136-1138.
- Tay J, Parker H, Dhange P y col. Isolated torsion of the fallopian tube in a patient with polycystic ovarian syndrome (PCOS). Eur J Obstet Gynecol Reprod Biol 2010; 150(2): 218-219.
- Laufer MD. Ovarian and fallopian tube torsion. Post TW, ed. Waltham, MA: UpToDate Inc. http://www.uptodate.com (consultado 26/06/2021).
- Kim MY, Rha SE, Oh SN y col. MR Imaging findings of hydrosalpinx: a comprehensive review. Radiographic 2009; 29(2): 495-507.
- Cabral MD, Siqueira LM. Hydrosalpinx in postmenarchal nonsexually active girls: a review of 6 cases in a children's hospital. J Pediatr Adolesc Gynecol 2015; 28(6): e203-e207.
- Casey RK, Damle LF, Gomez-Lobo V. Isolated fallopian tube torsion in pediatric and adolescent females: a retrospective review of 15 cases at a single institution. J Pediatr Adolesc Gynecol 2013; 26(3): 189-192.
- Rosenfield Robert L. Diagnostic evaluation of polycystic ovary syndrome in adolescents. En Up to date Post TW (Ed), UpToDate, Waltham, MA. (consultado 27/06/2021).
- Rosenfield Robert L, Definition, clinical features, and differential diagnosis of polycystic ovary syndrome in adolescents. En: Up to date Post TW (Ed), UpToDate, Waltham MA. (consultado 26/06/2021).
- Rosenfield RL. Perspectives on the International Recommendations for the Diagnosis and Treatment of Polycystic Ovary Syndrome in Adolescence. J Pediatr Adolesc Gynecol 2020; 33(5): 445-447.
- Teede HJ, Misso ML, Costello MF y col. Recommendations from the international evidence-based guideline for the assessment and management of polycystic ovary syndrome. Fertil Steril 2018; 110(3): 364-379.
- Fruzzetti F, Campagna AM, Perini D, Carmina E. Ovarian volume in normal and hyperandrogenic adolescent women. Fertil Steril 2015; 104(1): 196-199.
- Kenigsberg LE, Agarwal C, Sin S y col. Clinical utility of magnetic resonance imaging and ultrasonography for diagnosis of polycystic ovary syndrome in adolescent girls. Fertil Steril 2015; 104(5): 1302-1309.
- Kayemba-Kay's S, Pambou A, Heron A, Benosman SM. Polycystic ovary syndrome: Pelvic MRI as alternative to pelvic ultrasound for the diagnosis in overweight and obese adolescent girls. Int J Pediatr Adolesc Med 2017; 4(4): 147-152.
1. Médica ginecóloga, especialista en ginecología infantojuvenil. Médica de planta, Unidad de Ginecología Infantojuvenil, HIAEP Sor María Ludovica, La Plata, Argentina
2. Médica, especialista en ginecología. Médica de planta, Unidad de Ginecología Infantojuvenil, HIAEP Sor María Ludovica, La Plata, Argentina
3. Médica, especialista en diagnóstico por imágenes. Servicio de Radiología, Hospital Italiano, La Plata, Argentina
4. Médico, especialista en ginecología. Instituto Médico Platense, La Plata, Argentina

