Impacto del estrés psicofísico en las alteraciones psicoendocrinas
Impact of psychophysical stress in psychoendocrine disorders
Trabajo Original • Dra. Inés de la Parra*
RESUMEN
Frente a una situación de agresión física o psíquica, existen diferentes tipos de respuesta posibles según las características del individuo. El estrés es un mecanismo normal de respuesta adaptativa, que logra mantener la homeostasia frente a una situación adversa.
En cambio, en el distrés o estrés negativo, la adaptación a una situación adversa es fallida. La resiliencia es la capacidad adaptativa del individuo para desarrollar de manera saludable mecanismos psicosocioculturales frente a contextos adversos.
En el estrés intervienen numerosos neurotransmisores como la serotonina, la noradrenalina y la dopamina. Ante la situación de estrés, se activan el sistema límbico, el eje hipotálamo-hipófiso-adrenal, la hormona de crecimiento (GH), la prolactina, las citoquinas y la vasopresina. También interviene el eje opioide, aumenta la β-endorfina, la encefalina y la dinorfina, y se activa el circuito opioide endógeno que inhibe las sensaciones dolorosas.
A nivel gonadotrófico, los neurotransmisores estimulan el factor liberador de corticotrofina (CRF), que estimula la secreción de adrenocorticotrofina (ACTH) y esta, la del cortisol (glucocorticoide suprarrenal). El cortisol, la ACTH y el CRF actuarán sobre el hipotálamo inhibiendo la secreción de GnRH, que tendrá como consecuencia el descenso de la hormona luteinizante (LH) y, posteriormente, de la hormona foliculoestimulante (FSH). Este descenso de las gonadotrofinas conlleva una disminución a nivel ovárico y testicular de estradiol (E2), progesterona o testosterona, así como la inhibición a su vez del eje tiroideo, lo que favorece el depósito de grasa a nivel abdominal. En el estrés agudo se observa disminución de la dehidroepiandrosterona (DHEA). En el estrés crónico se produce inmunosupresión, lo que lleva a la aparición de infecciones. Las citoquinas más importantes involucradas son IL-1, IL-2, IL-12, GH y el factor de necrosis tumoral alfa (TNF-α). Los cambios endocrinos por estrés dependen del momento de la vida en que este se presente; puede iniciarse en la vida fetal o durante su transcurso.
La reprogramación fetal sería la adaptación fisiológica por efecto de un estímulo precoz en un período sensible del desarrollo fetal, lo que provoca resultados adversos a largo plazo. Los disruptores endocrinos o la desnutrición pueden actuar como agentes de reprogramación.
Las causas de estrés en la infancia y en la adolescencia son numerosas: abuso sexual, maltrato, trastornos de la conducta alimentaria, sobreentrenamiento físico, etc. y pueden presentarse patologías a corto o largo plazo como el síndrome metabólico, la enfermedad cardiovascular, la obesidad, etc.
Es importante poder detectar tempranamente las situaciones de estrés para prevenir las consecuencias patológicas que conllevan.
Palabras clave: estrés, distrés, resiliencia, alteraciones endocrinas, inmunológicas, estrés materno, reprogramación, infancia, adolescencia, enfermedad cardiovascular, sobreentrenamiento físico, trastornos de la conducta alimentaria.
SUMMARY
Faced with a situation of physical or psychic aggression there are different types of possible responses according to the characteristics of the individual. Stress is a normal mechanism of adaptive response, which manages to maintain homeostasis in the face of an adverse situation.
In contrast to distress or negative stress, adaptation to an adverse situation is flawed. Resilience is the individual’s adaptive capacity to develop healthy psychosocial-cultural mechanisms in the face of adverse contexts.
Stress involves numerous neurotransmitters such as serotonin, noradrenaline, dopamine. In view of the stress situation, the limbic system, hypothalamic hypophysis adrenal axis, growth hormone (GH), prolactin, cytokines and vasopressin are activated. The opioid axis also intervenes, increases β-endorphin, enkephalin, dynorphin, activating the endogenous opioid circuit that inhibits painful sensations.
At the gonadotrophic level, neurotransmitters stimulate the corticotrophin-releasing factor (CRF) that stimulates the secretion of ACTH and this one of the cortisol (adrenal glucocorticoid). Cortisol, ACTH and CRF will act on the hypothalamus by inhibiting GnRH secretion, which will lead to a decrease in LH and subsequently in FSH. This decrease in gonadotropins leads to a decrease in the ovarian and testicular levels of estradiol (E2), progesterone or testosterone, as well as the inhibition in turn of the thyroid axis, favoring the deposition of fat at the abdominal level. In acute stress, there is a decrease in dehydroepiandrosterone (DHEA). In chronic stress, immunosuppression occurs, leading to the appearance of infections. The most important cytokines involved are IL 1-2-12 GN TNF-α. The endocrine changes by stress depend on the moment of life in which it is present and can begin in fetal life or during the course of it.
Fetal reprogramming would be the physiological adaptation due to an early stimulus in a sensitive period of fetal development, which causes adverse long-term results. Endocrine disruptors or malnutrition can act as reprogramming agents.
The causes of stress in childhood and adolescence are numerous: sexual abuse, abuse, eating disorders, physical over-training, etc; It can present short or long term pathologies such as metabolic syndrome, cardiovascular disease, obesity, etc.
It is important to be able to detect stress situations early, thus preventing the pathological consequences that entail.
Keywords: stress, distress, resilience, endocrine alterations, immunological, maternal stress, reprogramming, childhood, adolescence, cardiovascular disease, physical overtraining, eating disorders.
INTRODUCCIÓN
Hace más de medio siglo que diferentes autores demostraron la relación entre los mecanismos límbico-hipotálamo-hipofisarios asociados a la disfunción gonadal, como respuesta al estrés emocional1.
El estrés es uno de los problemas de salud más importantes en las sociedades modernas y en el siglo XXI.
El trauma psíquico se define desde el psicoanálisis “como un acontecimiento en la vida del sujeto que se caracteriza por su intensidad, por la incapacidad del sujeto para responder adecuadamente a él y por los efectos patógenos y duraderos que provoca en el organismo”2.
Frente a una situación de agresión física o psíquica, existen diferentes tipos de respuesta posibles según las características del individuo.
El estrés es la respuesta adaptativa del organismo ante la demanda externa e interna de la vida diaria. Se requieren ajustes fisiológicos y psicológicos del individuo para mantener la homeostasia en el sistema nervioso central.
En los últimos años, se considera el estrés psicosocial como el agente estresante más importante.
Según A. Márquez1 existiría una predisposición genética asociada a antecedentes adversos tempranos como el caso del abuso sexual, maltrato, abandono, etc., que en una persona con fenotipo vulnerable puede producir, a corto o largo plazo, traumas en la infancia, adolescencia o edad adulta con alteraciones biológicas, psicológicas, endocrinas, metabólicas, emocionales o conductuales.
En el caso de fenotipos resilientes, se presentaría con una genética no alterada, asociado a experiencias infantiles de amor, contención y expectativas de límites. Esto daría un fenotipo resiliente con homeostasia autonómica permanente. Aprovecharía esta crisis para su crecimiento con adecuada neuroplasticidad y adecuado balance psiconeuroendocrino, lo que llevaría a una personalidad autónoma, creativa y resolutiva, con capacidad de adaptación conductual, flexibilidad cognitiva, capacidad plástica y capacidad de pensamiento crítico3. Podemos entonces decir que... “hay genética que nos protege contra las lesiones ambientales”1.
- Estrés: (del griego stringere) significa ‘provocar tensión’. Es un mecanismo normal que logra mantener la homeostasia frente a cualquier situación que implique respuesta adaptativa fisiológica.
- Distrés o estrés negativo: la adaptación a situaciones adversas es fallida. Es una respuesta desadaptativa patológica que genera ansiedad, irritabilidad y dificultad psicosocial. A su vez, puede ser el inicio de enfermedades psiquiátricas o no psiquiátricas.
- Resiliencia: capacidad que tienen las personas para desarrollarse de manera psicológicamente saludable aun viviendo en contextos adversos3. “Es aquel que enfrenta una situación hostil y/o abusiva y sale fortalecido”.
Hasta hace unos años se consideraba que el estrés se presentaba en el período posnatal, infancia, adolescencia o edad adulta. En la actualidad, a través de nuevas investigaciones, se ha demostrado que el estrés puede comenzar incluso en la etapa prenatal. Las experiencias vitales fundamentalmente tempranas, tanto físicas como psicológicas, interactúan produciendo alteraciones funcionales.
Los individuos sometidos a estrés presentan mayor vulnerabilidad a la depresión, trastornos de ansiedad y menor respuesta a factores estresantes en la vida adulta.
En este mecanismo participarían el eje adrenal y la corteza del hipocampo. A su vez existirían asociadas alteraciones de los receptores para glucocorticoides suprahipotalámicos. El hipertono noradrenérgico y el aumento de toxicidad llevarían a una disfunción del cerebro, del sistema endocrino y del sistema inmunológico.
Estas alteraciones volverían a la persona más vulnerable a padecer ciertos trastornos, como depresión o ansiedad.
Estrés agudo
Se presenta en respuesta a la percepción de una amenaza inmediata, ya sea física, emocional o psicológica. El estrés agudo activa el sistema nervioso autónomo, se liberan mayores cantidades de cortisol, noradrenalina, adrenalina y de otras hormonas que desencadenan lo que se conoce como la “respuesta de lucha”.
Estrés crónico
A diferencia del estrés agudo, que tiene una duración limitada, el estrés crónico es una respuesta desadaptativa a los acontecimientos desagradables en un período prolongado de tiempo. El comportamiento del eje adrenal es homologable al que se observa en los cuadros depresivos. En el estrés crónico, se produce inmunodepresión, lo que acarrea posteriormente enfermedades crónicas, infecciones, enfermedad cardiovascular, obesidad, síndrome metabólico, siendo esto todavía controvertido5,6.
En el estrés crónico se produce un aumento del CRF, la ACTH y el cortisol, que suprime la respuesta inflamatoria. En los últimos estudios se evaluó el rol que juegan las citoquinas como mediadoras del estrés crónico (interleuquina I, II y factor de necrosis tumoral) en la activación del eje hipotálamo-adrenal8. La respuesta del eje suele ser de hiperactividad y puede también ser de hipoactividad, con una disminución de los niveles de cortisol libre por una gran inhibición del eje.
La carga alostática es la adaptación forzada, es una medida de riesgo acumulada. Es el costo que paga el organismo por su esfuerzo adaptativo.
Neuroquímica del estrés
Se encuentran numerosos transmisores implicados en el estrés crónico, entre ellos:
- Serotonina.
- Noradrenalina.
- Dopamina.
Serotonina
Estimula la liberación de CRF con el consecuente aumento de la liberación de ACTH por la hipófisis.
Ante el estrés crónico, se produce una disminución en el funcionamiento del sistema serotoninérgico que es fundamental para el desarrollo de la depresión o ansiedad1.
Noradrenalina
El sistema noradrenérgico está regulado por un núcleo situado en el locus coeruleus. La activación de este sistema produce liberación de noradrenalina, lo que provoca un estado de alerta fundamental para la adaptación al estrés. En el estrés crónico se produciría una disminución en la síntesis y liberación de este neurotransmisor.
Dopamina
La dopamina está involucrada tanto en el estrés como en la depresión. El estrés altera la síntesis y liberación de dopamina a la vía mesolímbica, lo que conduce a la falta de iniciativa e indiferencia emocional.
Los mecanismos desencadenados por el estrés físico, psicológico o psicosocial activan el sistema simpático y estimulan la liberación hipofisaria de las hormonas del estrés: ACTH, hormona de crecimiento (GH) y prolactina.
Regulación del eje opioide
Dentro de las funciones del sistema opioide, además de la regulación del dolor, se encuentra la respuesta al estrés. Hay numerosos neurotransmisores involucrados, entre ellos:
- β-endorfina.
- Encefalina.
- Dinorfina.
Los receptores opioides son kappa (Kor), MAPK (p38), las neuronas GABA y la corteza del hipocampo.
En el primer momento de la lesión traumática, ante el dolor, se produciría una analgesia inducida por el estrés a través del eje opioide.
El estrés activa el circuito opioide endógeno que inhibe las sensaciones dolorosas, actuando a nivel medular10.
Esto fue observado por los médicos de la Segunda Guerra Mundial en los traumatizados que referían dolor recién luego de unas horas de la lesión.
Regulación del estrés
- Sistema hipotálamo-hipófiso-adrenal.
- Sistema simpático adrenérgico.
- Citoquinas.
Figura 1. Efecto de la activación de los diferentes ejes.

Eje adrenal
La respuesta del eje adrenal junto con la secreción de glucocorticoides y catecolaminas es la principal respuesta neuroendocrina metabólica al estrés7.
En condiciones de estrés, la liberación de ACTH mediada por el CRF está determinada por diversas modificaciones. Los impulsos varían según el tipo, la intensidad y la duración de las situaciones de estrés. El incremento de CRF-ACTH se asocia con una alteración en la secreción de prolactina, aumento de oxitocina, vasopresina y norepinefrina.
Vasopresina u hormona antidiurética1
Junto con el cortisol, es la principal hormona en la respuesta al estrés y regula el eje hipotálamo-hipófiso-adrenal. Actúa a nivel de la hipófisis estimulando la liberación de corticotrofina, además de actuar sobre el equilibrio hidroelectrolítico. Jugaría un rol más específico en el estrés crónico.
El factor natriurético atrial inhibe la secreción de CRF y de vasopresina anulando sus funciones depresoras ante el estrés.
Otro péptido que interviene en la respuesta al estrés es la kisspeptina, identificada en 1999, producto del gen Kiss1. La kisspeptina es una proteína que actúa sobre un receptor acoplado a la proteína G (receptor GPR43). La kisspeptina cumple un rol fundamental en la secreción de gonadotrofinas para el inicio de la pubertad y la reproducción en la vida adulta.
Las células productoras de kisspeptina reciben señales inhibitorias desde el eje adrenal y el ambiente a través del núcleo supraquiasmático del hipotálamo11. Como consecuencia de esto se produciría un hipogonadismo hipogonadotrófico asociado a una deficiencia de la secreción de LH-FSH. Lo primero en afectarse es la frecuencia de los pulsos de secreción de LH. A continuación esta alteración se agrava y disminuyen también los pulsos de FSH; incluso puede presentarse una regresión de los patrones de pulsatilidad hacia el estado prepuberal. Esto se ve con frecuencia en las pacientes con anorexia nerviosa (AN) con pérdida de peso extrema y en el estrés (Yen, 1991).
No solamente está alterada la secreción cuantitativa de las gonadotrofinas, sino que también se altera su calidad (alteración en la glicosilación). Esto llevaría a un menor efecto de las gonadotrofinas sobre sus órganos blanco: los ovarios y los testículos12-13.
Figura 2. Estress Alteración del eje hipotalo hipofiso gonadal adrenal.
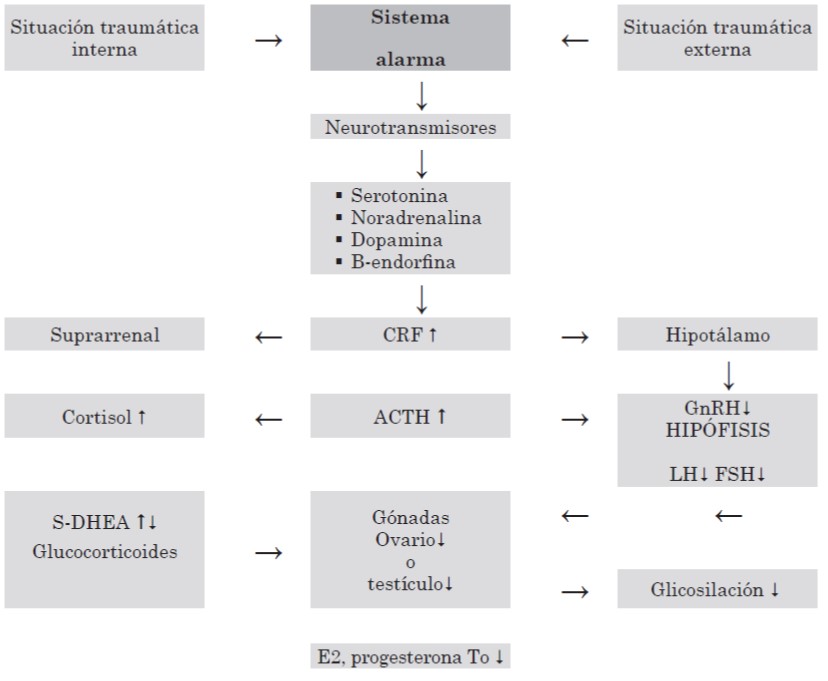
Eje tiroideo
La función tiroidea se encuentra inhibida por la disminución de la producción de hormona estimulante de la tiroides (TSH) e inhibición de la conversión periférica de T4 a T3. En la depresión endógena unipolar no se registran alteraciones de los niveles basales de hormona tiroidea.
Eje prolactínico
Se ha comprobado que los niveles de prolactina se incrementan en el estrés agudo. En el estrés crónico pueden encontrarse tanto niveles altos como disminuidos.
Melatonina
En las pacientes con amenorrea hipotalámica psicógena se puede observar un aumento significativo de la secreción nocturna de melatonina14. Las concentraciones diurnas de esta hormona son similares en las pacientes con estrés y en las del grupo control.
Hormona de crecimiento
En el inicio a la respuesta del estrés o tras la administración aguda de glucocorticoides se produce una elevación aguda de las concentraciones de GH.
Los niveles medios de GH en 24 h se cuentan dentro de límites normales, pero con una alteración en el patrón de pulsatilidad, con una disminución de la amplitud de los pulsos y un aumento de la frecuencia con aumento total del ciclo sueño y vigilia9,15.
También se observa un aumento del nivel de las proteínas fijadoras del factor de crecimiento insulino-símil (IGF-I), al igual que los glucocorticoides, lo que determina un aumento de la producción hepática de IGF-I por la insulina (Suikkari M, 1989; Paoz, 1993).
Niveles de leptina y ritmo diurno
Los niveles de leptina presentan patrones diurnos similares en las pacientes con amenorrea hipotalámica hipogonadotrófica psicógena y en los controles con ciclos normales, con un nivel mínimo a las 9 de la mañana después de un ayuno nocturno, hasta alcanzar el nivel máximo a la 1 de la mañana. En esto no se encuentra diferencia con los controles normales (en las mujeres con amenorrea asociada al ejercicio y con poco tejido graso, el nivel de leptina está muy reducido).
El nivel medio de leptina en controles normales es de 10,0±1,3 mg/ml, igual que en las amenorreas psicógenas. En cambio, en amenorreas por ejercicio o AN, el nivel es menor (7±1,5 mg/ml)9.
Efectos sobre el tejido adiposo
El estrés aumenta el número de receptores de glucocorticoides en el tejido adiposo abdominal, lo que provoca una hipersensibilidad de los adipocitos intraabdominales al cortisol16.
La producción aumentada de las citoquinas IL-6 y leptina, así como de ácidos grasos libres, tiene efecto sobre la síntesis y secreción del CRF.
Obesidad
La actividad crónica del sistema de estrés está asociada con la adiposidad visceral, disminución de masa magra (huesos y músculos) y supresión de la actividad osteoblástica, un fenotipo observado en pacientes con síndrome de Cushing y en pacientes con síndrome metabólico15.
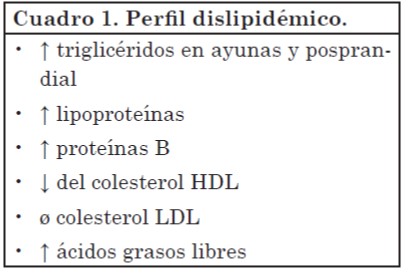
Metabolismo de las lipoproteínas
El perfil de lipoproteínas observado durante el estrés es consecuencia de la insulinorresistencia e hiperinsulinemia. El aumento de la adiposidad visceral producido por los glucocorticoides genera resistencia a la insulina y deterioro del control glucémico.
Perfil dislipidémico
Metabolismo de los hidratos de carbono
Los glucocorticoides alteran el metabolismo de los carbohidratos al inhibir la insulina, pues traslocan intercelularmente los transportadores de glucosa (Glut4) a la superficie celular, lo que disminuye la captación periférica de glucosa en el núcleo y el tejido adiposo17.
Efecto sobre la insulina
El cortisol, la adrenalina y la noradrenalina se oponen a los efectos de la insulina. Se propuso que una excitación hipotalámica puede contribuir a la resistencia insulínica (RI) por la producción excesiva de cortisol18,19.
El exceso de glucocorticoides endógeno o exógeno se asocia con RI, intolerancia a la glucosa, obesidad central, hipertensión, etc.
La disminución de GH y de las hormonas sexuales que acompañan a los estados de estrés crónico produce una inhibición en la síntesis de la enzima lipoproteína-lipasa. Esta enzima es la responsable del catabolismo de los quilomicrones y lipoproteínas de muy baja densidad (VLDL), por lo que el estrés crónico se caracteriza por presentar hipertrigliceridemia16.
Dehidroepiandrosterona (DHEA)
Es el esteroide más abundante que se sintetiza en la capa reticular de las glándulas adrenales, las gónadas y el cerebro. Presenta efecto protector a nivel cerebral. Estimula la síntesis glial del factor neurotrófico o factor de crecimiento insulínico tipo 1 (IGF-I). Genera un mecanismo antiapoptótico y neuroprotector mediante el aumento del flujo cerebral a nivel endocrino, cardiovascular y metabólico. Por lo tanto, esta hormona protege de los efectos de los corticoidesdurante el estrés. Se han observado valores disminuidos de DHEA en el estrés agudo y variables en el estrés crónico y depresión2.
Eje córtico-límbico- hipotálamo-hipófiso-inmunológico
A partir de los años 90, numerosos estudios demostraron la acción del estrés sobre la respuesta inmunológica20.
En 1995, se modifica el estudio y se observa la progresiva adiposidad visceral inducida por lo glucocorticoides causando mayor resistencia a la insulina y al deterioro del control glucémico (Steimberg, 1989). En el estrés crónico se produce inmunodepresión y esto acarrea la aparición de infecciones.
La acción de los glucocorticoides sobre el SNC produciría una inmunomodulación y luego aparecería la depresión, aunque no todas las citoquinas son inhibidas.
Las citoquinas median la información entre el sistema inmune y el SNC.
Las citoquinas más importantes que actúan en el SNC son IL-1, IL-2, IL-12, GH y TNFα; estas pueden inhibir o estimular el eje hipotálamo-pituitario-adrenal (HHA).
Estrés en el transcurso de la vida
Figura 3: Función inmunológica
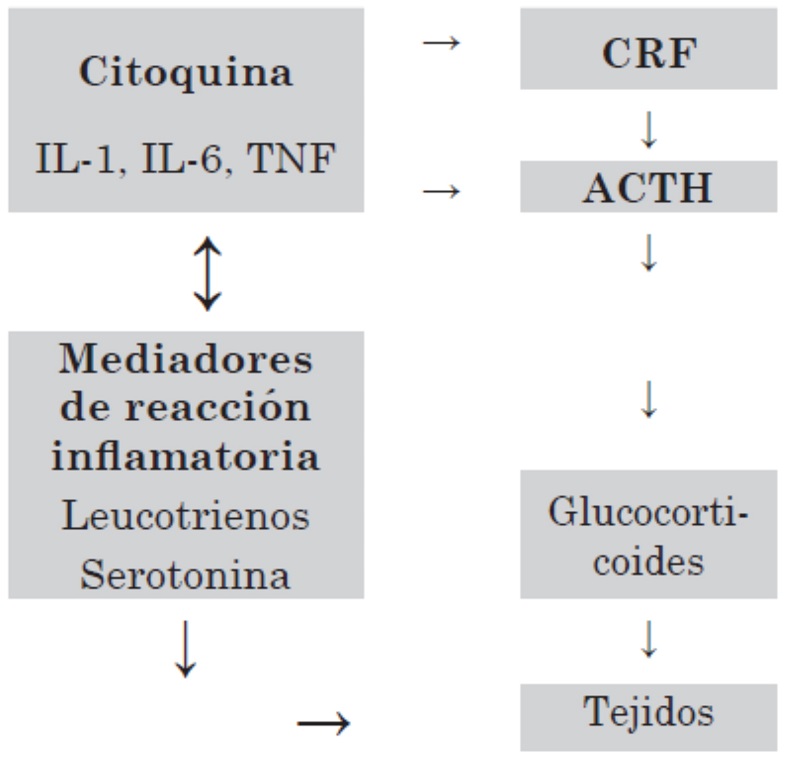
Los cambios endocrinos por estrés dependen del momento de la vida en que este se presenta, puede iniciarse en la vida fetal y finalizar cuando el individuo alcance la madurez sexual.
“El ser humano ya en la infancia posee conciencia, siente, piensa y percibe emociones”.
Estrés materno
Diversos estudios han confirmado que el estrés materno puede condicionar el descuadro emocional y conductual del niño incluso hasta el inicio de la vida adulta. Esto está mediado por el eje hipotálamo-hipófiso-adrenal, y los cambios adquiridos pueden transmitirse a la descendencia4.
El estrés conduce a respuestas neuroendocrinas que con el tiempo pueden ser de importancia en el desarrollo de diversas patologías.
Hay una asociación significativa entre las alteraciones emocionales en el 3º trimestre del embarazo y los problemas de conducta en la primera infancia.
El estrés materno durante momentos críticos del desarrollo fetal puede alterar el desarrollo cerebral, lo que determina mayor vulnerabilidad. Se evidencia mayor secreción de cortisol que en el grupo control. También se ha observado que esta situación traumática materna tiene efectos diferentes en los diversos momentos del embarazo.
A partir de los trabajos de David Barker22 se ha demostrado que los estímulos a los que se enfrenta el feto en crecimiento son importantes para explicar el desarrollo de enfermedades crónicas que se expresan en la edad adulta. El feto presenta un período crítico, sensible al medio ambiente22.
Según Lucas23, la programación fetal es la adaptación fisiológica por efecto de un estímulo precoz en un período sensible del desarrollo fetal, lo que genera problemas funcionales a largo plazo.
Se han propuesto varios mecanismos para fundamentar la programación fetal. Hormonas como la insulina, el IGF-1, la tiroxina, los glucocorticoides y los esteroides sexuales (andrógenos, progesterona) regulan el crecimiento fetal y el desarrollo de tejidos específicos y desempeñarían un papel importante en la reprogramación fetal24. La reprogramación fetal permitiría actuar como señales endocrinas o adaptativas a situaciones adversas.
Las hormonas pueden actuar directamente por vía genómica o no en el desarrollo placentario y en el modulador fetal, junto con los factores de crecimiento en la unidad feto-placentaria25.
Origen de las hormonas fetales26:
- Propias glándulas fetales (tiroides, adrenal, hipófisis, páncreas).
- Derivar de los tejidos uteroplacentarios (esteroides, péptidos y glicoproteínas), secretadas por la circulación transplacentaria.
- Originadas en la madre y se transportan al feto por difusión transplacentaria (esteroides, hormonas tiroideas).
También, de acuerdo con los nuevos estudios experimentales, se ha comprobado que los disruptores endocrinos de origen ambiental podrían actuar como agentes de programación, produciendo alteraciones en el sistema reproductivo y en las funciones metabólicas e inmunológicas de la memoria y de la conducta de la descendencia.
Actualmente también se acepta que las hormonas endógenas del feto pueden actuar como disruptores endocrinos al encontrarse en concentraciones suprafisiológicas.
Por lo tanto, un disruptor endocrino sería cualquier hormona que produce disbalance en el sistema endocrino27,28.
Estas sustancias tóxicas no actuarían solamente en la vida fetal, sino en cualquier momento de la vida de la persona.
Es importante concientizar a la población y a los equipos de salud pública a nivel mundial para que se adopten medidas de protección tanto para mujeres como para hombres, principalmente en zonas industrializadas como de petroquímica28.

Nutrición
Uno de los factores estresantes puede ser la nutrición en la vida fetal y primera infancia, ya que tiene efecto sobre el metabolismo, el neurodesarrollo y la predisposición a enfermedades como hipertensión, diabetes, obesidad y alteración de la mineralización ósea.
Son múltiples los factores que pueden estimular o retrasar el crecimiento y el desarrollo fetal, como por ejemplo, el peso al embarazarse y la ganancia de peso durante el embarazo. Entre las complicaciones del niño a corto plazo se encuentra la hipotonía neonatal y la dificultad para regular la temperatura corporal29 y a largo plazo, podrían ser la hipertensión o la enfermedad coronaria entre otras.

En los últimos años, se han desarrollado numerosos estudios que demostraron la acción de la desnutrición materna sobre el embarazo.
La desnutrición infantil es un tema capital y su abordaje es prioritario. Desnutrición no es solamente la falta de alimentos, sino un conflicto más profundo, que se observa en la adolescencia y la vida adulta.
Quien ha sido desnutrido y no fue tratado a tiempo, cargará con una discapacidad a largo plazo pues podría desarrollarse una atrofia cerebral31.
Peso al nacer
El peso al nacer se relaciona con las enfermedades futuras, en particular con las enfermedades coronarias y con la diabetes tipo 2; estas patologías pueden exacerbarse con las condiciones ambientales en la vida extrauterina temprana y el medio socioambiental del individuo22.
Este bajo peso estaría relacionado con el escaso suministro de nutrientes al feto y, por lo tanto, esto actuaría desviando su normal trayectoria y produciendo cambios epigenéticos2.
Al final de la Segunda Guerra Mundial, tras la liberación de Amsterdam (Holanda) de la ocupación Nazi, se observó un aumento significativo del número de embarazos asociado a la realimentación de las mujeres desnutridas.
Como consecuencia de esto, se observó que los niños que nacieron a posteriori presentaron una alta tasa de teratogénesis, producto de la desnutrición.
Otro ejemplo del impacto de la desnutrición sobre la programación fetal se evidencia en un estudio realizado en los sobrevivientes al Sitio de Leningrado (ciudad sitiada por más de dos años durante la Segunda Guerra Mundial, en donde sus habitantes fueron expuestos a terribles hambrunas). Los recién nacidos de hijos de mujeres sobrevivientes al sitio presentaron mayor prevalencia de hipertensión y enfermedad cardiovascular en la edad adulta que los controles32.
Repercusión del estrés en la infancia/adolescencia
Algunos investigadores sugieren que las experiencias adversas en la infancia se asocian con cambios en los sistemas alostáticos. Estos niños tienen mayor activación del eje HHA comparados con niños que no tienen antecedentes de exposiciones traumáticas.
Las experiencias estresantes aumentan la reactividad de los estresores, lo que incrementa la ansiedad y la depresión.
R. Boynton-Jarrett halló que aquellos niños que tenían antecedentes de abuso sexual infantil y/o maltrato físico presentaban retraso en la edad de menarca y un mayor riesgo de trastornos menstruales33,34.
Las causas por las cuales las adolescentes presentan alteraciones menstruales como consecuencia del estrés son múltiples.
Las alteraciones menstruales son dependientes del momento de la vida en que se produce la exposición al estrés. Por ejemplo, si el estrés se produce en la primera infancia, las pacientes pueden presentar retraso puberal o amenorrea primaria. Si, en cambio, la exposición se da en la infancia tardía, puede manifestarse como amenorrea secundaria o irregularidades menstruales. Esto también se ve influenciado por otros factores que acompañan el trauma, como la carga genética, la vulnerabilidad de la persona, el consumo de drogas y/o alcohol, la ausencia de familia, etc.
Causas de estrés. Desencadenantes de patologías
- Maltrato infantil.
- Abuso sexual.
- Trastornos de la conducta alimentaria (TCA).
- Sobreentrenamiento físico.
- Agentes tóxicos:
- Abuso de drogas: cocaína, marihuana, alcohol.
- Tratamientos hormonales, quimioterapia, anticoagulantes.
- Enfermedades sistémicas crónicas:
- Diabetes, fibrosis quística, enfermedad de Crohn, insuficiencia hepática o renal, síndrome de malabsorción, etc.
- Desnutrición.
- Obesidad, síndrome metabólico.
- Enfermedades psiquiátricas:
- Depresión.
- Uso de psicofármacos.
- Alteración del eje gonadotrófico y adrenal.
- Alteración de neurotransmisores cerebrales.
- Enfermedad cardiovascular
Rol del maltrato infantil
El maltrato infantil puede presentarse como:
- Maltrato físico, emocional, desatención.
- Abuso sexual, explotación comercial, sexual, etc.
Estas situaciones ocasionan un daño real a la salud del niño en su relación de confianza con padres o tutores35, muchas veces se retrasa el diagnóstico por no pensar en este tipo de situaciones.
En este problema intervienen múltiples factores familiares, sociales, culturales, nivel económico bajo, déficit de vitamina B12, intoxicación, abandono emocional, lesiones accidentales, explotación laboral, maltrato físico y otros. Por ejemplo, el síndrome de Munchhausen en los padres (simulación de problemas físicos por parte de la madre35).
Manifestaciones compatibles con maltrato psicológico
Puede observarse hostilidad hacia el menor o adolescente de manera persistente. Exposición a experiencias traumáticas, aislamiento, educación inconveniente por parte de la madre, padre o cuidadores35.
Es importante en el tratamiento evitar “el encarnizamiento diagnóstico” porque podemos revictimizar al niño; es importante reponer el daño sufrido y sus consecuencias a futuro.
Abuso sexual infantil (ASI)
Son numerosas las circunstancias que marcan la diferencia en el impacto psíquico que vive el niño/a que padece abuso sexual. Es una situación traumática para la víctima que la lleva a serias consecuencias. Es importante reconocer que las agresiones sexuales no afectan la honra o la honestidad de las víctimas, sino su integridad y dignidad como persona35.
Este trauma desencadena en el aparato psíquico del niño una alteración que supera la capacidad de procesarlo y esto se manifiesta con diferentes síntomas, a saber: erotización de relaciones interpersonales, sexualidad prematura, masturbación compulsiva, anorgasmia, disfunción sexual, enuresis, etc.
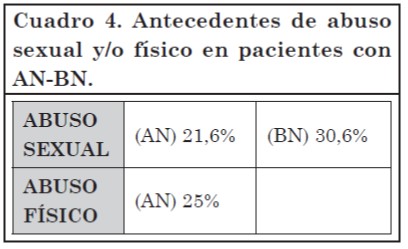
El antecedente de ASI es frecuente en pacientes con TCA, principalmente en AN o bulimia nerviosa (BN). Diversos trabajos investigaron esta experiencia traumática infantil (abuso físico y/o sexual) en este tipo de patología pues puede producir repercusiones biológicas, psicológicas o sociales y tener efecto sobre la imagen corporal, identidad, autoestima, etc.
El ASI es considerado factor de riesgo para BN entre 1/6 y 1/3 de los casos severos de bulimia.
Este antecedente aumenta si va acompañado de comorbilidades tales como depresión, alcoholismo, promiscuidad, cleptomanía o intentos de suicidio.
Sobre este tema es fundamental realizar tareas de percepción ya que entre el 30-40% de las pacientes que fueron victimizadas durante la infancia suele repetir abuso físico y/o sexual durante la adultez37.
En el centro de AN y BN del Hospital Italiano de Buenos Aires se evaluaron 340 pacientes con AN-BN (332 mujeres y 8 varones), edad promedio de 22,9 años (Cuadro 4)38
Si la AN se instala en períodos tempranos de la vida, puede presentarse con retraso puberal asociado a desnutrición y alteración de la masa ósea.
En la actualidad, la presentación de esta patología se ve cada vez a edades más tempranas e incluso en la infancia.
Sobreentrenamiento físico
La popularidad del ejercicio físico en las últimas décadas condujo a la identificación de algunos efectos nocivos del ejercicio intenso sobre la función reproductiva.
Los factores que deben considerarse para evaluar las consecuencias neuroendocrinas y metabólicas del ejercicio consisten en lo siguiente:
Es importante la edad de comienzo del entrenamiento intensivo. En período de vacaciones, muchas de estas deportistas que se encontraban en amenorrea comienzan a menstruar. Otro de los problemas que hay que evaluar es la posibilidad de la asociación con TCA. Se debe recordar en qué consiste la trilogía de la atleta:
- Alteración en los ciclos menstruales o amenorrea.
- Alteración en la masa ósea (osteopenia).
- TCA.
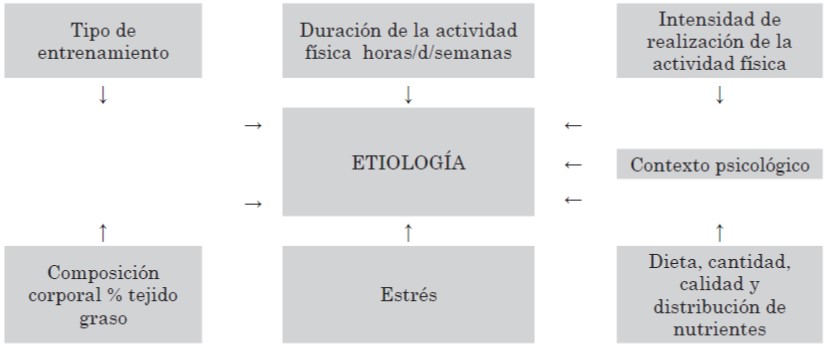
En los últimos años, se sugiere que el factor determinante de la disfunción menstrual sería el consumo de energía. Pero también el estrés desempeñaría un papel en la presencia de amenorrea hipotálamo-hipofisaria con reducción de la fracción de los pulsos de LH37.
Figura 5. Sobre entrenamiento físico y su repercusión

Los posibles responsables de que en el deporte se produzcan alteraciones en la salud serían37:
- Padres en busca de trascendencia social y económica.
- Docentes, profesores y entrenadores en busca del reconocimiento de las instituciones a las que pertenecen.
- Médicos que desconocen la problemática del deporte.
- Factores individuales de la persona (personalidad exitista, etc.).
Diversos autores han propuesto que tanto la AN como la BN y la obesidad psicógena representarían el síndrome de estrés, asociado con una dificultad de adaptación psicosocial al medio que rodea al paciente como factor desencadenante principal.
Síndrome metabólico, obesidad, enfermedad cardiovascular
El estrés psicosocial, neuroendocrino, inmunogenético y oxidativo juegan un papel crítico en el desarrollo del síndrome metabólico, la diabetes tipo 2 y la enfermedad cardiovascular. Estas afecciones se han visto asociadas a un bajo estatus social en países económicamente desarrollados4,39,40.
El estrés conduce a respuestas neuroendocrinas que con el tiempo pueden ser de importancia en el desarrollo de la RI y la diabetes tipo 240.
El estrés, la depresión y la hipercortisolemia llevan a obesidad visceral y, posteriormente, a enfermedad cardiovascular. El cortisol actúa produciendo acumulación de grasa visceral, insulinorresistencia, diabetes tipo 2 (esto se demostró en modelos animales). El cortisol es importante pues incrementa la adiposidad visceral, así como también la posibilidad del síndrome metabólico40.
Los eventos estresantes, el bajo nivel educativo, el estrés laboral, el escaso apoyo emocional y los trastornos del sueño se han asociado a diferentes patologías como alteraciones menstruales, síndrome metabólico, obesidad abdominal, etc.
El estudio temprano en estas pacientes permitiría desarrollar medidas de prevención y terapéuticas tempranas.
La existencia de una red de contención como amigos, familia y colegas facilita las posibilidades de mejorar esta patología en comparación con los individuos que se encuentran solos.
COMENTARIO
Es importante que tanto la madre y la familia como el colegio, el equipo de salud y todos los que están en contacto con los niños/as y adolescentes tomen conciencia de esta patología para poder prevenir las complicaciones a corto o largo plazo.
Es ideal el abordaje con un equipo interdisciplinario que no solo evalúe las alteraciones biológicas, sino más profundamente lo psicosocial.
Es recomendable detectar la presencia de factores estresantes que se pueden presentar alrededor de estos niños/as y/o adolescentes tanto dentro del grupo familiar como de sus alrededores para prevenir situaciones patológicas.
También es conveniente poder detectar las situaciones de vulnerabilidad para así estar más atento ante los eventos traumáticos que los rodean.
Dentro del tratamiento de salud mental, es necesario poder aliviar el padecimiento psicológico y ayudar a superar el daño sufrido para prevenir las consecuencias a largo plazo. Es importante poder detectar tempranamente las situaciones de estrés.
Como bien dijo Claude Bernard en Francia, al referirse al estrés en Medicina, “el estrés es un evento necesario para permitir el aprendizaje y adaptación de un individuo, pero el estrés repetido podría llegar a una intensidad y duración mayor de lo que el individuo podría desarrollar”.
Referencias
- Márquez López Mato A. Estrés y resiliencia. Revista SAEGRE 2015; XXII(1):14-29.
- Laplancha J, Pontalis J. Diccionario de psicoanálisis (3a edición). Barcelona: Paidós Ibérica. 1981:447:51.
- Melillo A. Realidad social, psicoanálisis y resiliencia. En: Melillo A y cols. (eds.). Resiliencia y subjetividad. Los ciclos de la vida. Barcelona: Paidós. 2004.)
- Berg G, Fabre B. Estrés, obesidad y síndrome metabólico. Endocrinología Ginecológica. Una visión latinoamericana. Buenos Aires: Ediciones Journal. 2012: 141-148.
- Gidron Y, Ronson A. Psychosocial factors, biological mediators and cancer prognosis: a new look at an old story. Curr Opin Oncol 2008; 20:386-92.
- Smith PJ, Blumenthal J. Psychiatric and behavioral aspects of cardiovascular disease: epidemiology, mechanisms, and treatment. Rev Esp Cardiol 2011; 64:924-933.
- Axelrod J. Stress hormones: their interaction and regulation. Science 1984; 224:452.
- Pau KY, Spies HG. Neuroendocrine signals in the regulation of gonadotrophin releasing hormone secretion. Chin J Physiol 1997; 40:181-96.
- Laughhlin GA y cols. Nutritional and endocrine metabolic aberrations in women with functional hypothalamic amenorrhea. J Clin Endoc Med 1998; 83(1):25-32.
- Berga SL y cols. Neuroendocrine aberrations in women with functional hypothalamic amenorrhea. J Clin Endocrinol Metab 1989; 68(2):301-8.
- Nölting M, Pérez Lana MB. Amenorrea hipotalámica funcional. En. Nölting M, Pérez Lana MB (eds.). Pautas para el diagnóstico y tratamiento de los grandes síndromes endocrino-ginecológicos. Buenos Aires: Ascune Hnos. 2009:23-42.
- Holder M, Branstein J. Puberty and adolescence as a time of vulnerability to stressors that alter neurobehavioral processes. Frontiers in Neuroendocrinology 2014; 35:89-110.
- Benker G, Raida M y cols. TSH secretion in Cushing syndrome: relation to glucocorticoid excess, diabetes, goiter, and the ‘sick euthyroid syndrome’. Clin Endocrinol (Oxf) 1990; 33:777-86.
- Berge St, Mortola J y cols. Amplification of nocturnal melatonine secretion in women with functional hypothalamic amenorrhea. J Clin Endocrinol Metab 1988; 66:242.
- Charmandari E y cols. Endocrinology of the stress response. Ann Rev Physiol 2005; 67:259-84.
- Wajchenberg BL. Subcutaneous and visceral adipose tissue: their relation to the metabolic syndrome. Endocrin Rev Esp Cardiol 2011; 64:924-933.
- Rosmond R. Role of stress in the pathogenesis of the metabolic syndrome. Psycho 2005; 201-10.
- Rotter V y cols. Interleukin 6 (Il-6) induces insulin resistance in 3T3-L1 adipocytes and is, like IL-8 and tumor necrosis factor-alpha, overexpressed in human fat cells from insulin resistant subjects. J Biol Chem 2003; 278(46):45777-84.
- Bjorntorp P y cols. Hypothalamic arousal, insuline resistance and type 2 diabetes mellitus. Diabet Med 1999; 16:373-83.
- Márquez López Mato A. Psiconeuroendocrinología: todo y tiene que ver con todo y el todo es más que la suma de las partes. En: SAEGRE (eds.). Avances en Endocrinología Ginecológica y Reproductiva. Buenos Aires: Ascune. 2012:23-30.
- Magirena S. Epigenética y Programación fetal. Revista SAGIJ 2016; 23(1):18-27.
- Barker DJ. Crecimiento humano y enfermedad coronaria Impacto del crecimiento y desarrollo temprano sobre la salud y bienestar de la población. Buenos Aires: Instituto Danone del Cono Sur. 2009:15-32.
- Lucas A. Programming by early nutrition in man. En: Bock GR y cols. (eds.). The childhood environment and adult disease. Hoboken, NJ: J Wiley y sons. 1991:38-55.
- Chandole T. Chronic stress at work and the metabolic syndrome. BMJ 2006; 332:521.
- Fowden AL. The insulin like growth factors and fetoplacental growth. Placenta 2003; 24:803.
- Challis JRC, Sloboda D y cols. The fetal placental hyphotalamic-pituitary-adrenal (HPA) axis, parturition and post natal health. Mol Cell Endocrinol 2001; 185:135-44.
- Fisher JS. Environmental anti-androgens and male reproductive health: focus on phthalates and testicular dysgenesis syndrome. Reproduction 2004; 127:305-15.
- De la Parra I. Disruptores endocrinos y sustancias tóxicas, acción sobre el organismo y el eje reproductivo. En: SAEGRE (eds.) Ginecología infanto-juvenil. Un abordaje interdisciplinario. Buenos Aires: Ediciones Journal 2015:332-345.
- Murillo OL, Zea MP, Pradilla A. Situación nutricional de la gestante y el recién nacido en Cali, 2008. Rev Salud Pública 2011; 13(4):585-96.
- Mahan LK, Escott Stump S. Krause Dietoterapia. Barcelona: Masson. 2009.
- Vigo G. Erradicar la desnutrición infantil, la inversión social más importante. La Nación, 26 de enero de 2017.
- Koupil I, Shestov DB, Sparén P y cols. Blood pressure, hypertension and mortality from circulatory disease in men and women who survived the siege of Leningrad. Eur J Epidemiol 2007; 22:223-34.
- Boynton-Jarrett R y cols. Childhood abuse and age at menarche. Journal of Adolescent Health 2013; 52:241-247.
- Danese A, McEwen B. Adverse childhood experiences, allostasis, allostatic load, and age related disease. Physiology Behavior 2012; 106(1):29-39.
- Garrote N, Indart M. Maltrato y violencia familiar. En: SAEGRE (eds.). Ginecología Infanto Juvenil. Un abordaje interdisciplinario. Buenos Aires: Journal. 2015:705-710.
- Intebi I. Abuso sexual infantil en las mejores familias. Barcelona: Granica. 1998.
- de la Parra I, García A. Trastornos de la conducta alimentaria: anorexia nerviosa, bulimia nerviosa. En: SAEGRE (eds.). Avances en endocrinología ginecológica y reproductiva. Buenos Aires: Editorial Ascune Hnos. 2014:254-275.
- García Amusquibar AM. Experiencias traumáticas infantiles en pacientes con trastornos de la conducta alimentaria. Annals Psiquiatría Madrid 2005; (7):307-339.: Rev Arg de Psiquiatría 2001; XII:245-248).
- Brunner E, Hemingway y cols. Adrenocortical autonomic and inflammatory causes of the metabolic syndrome. Circulation 2002; 6:2659-65.
- Norberg M, Stenlund H. Components of metabolic syndrome predicting diabetes: no role of inflammation or dyslipidemia. Obesity (Silver Spring) 2007; 15(7):1875-85.
Servicio de Ginecología del Hospital Italiano de Buenos Aires
E-mail: Esta dirección de correo electrónico está siendo protegida contra los robots de spam. Necesita tener JavaScript habilitado para poder verlo.

